题目内容
14.某化学兴趣小组用如图所示装置探究浓硫酸与铜是否发生反应及反应所产生气体的性质,请回答下列问题: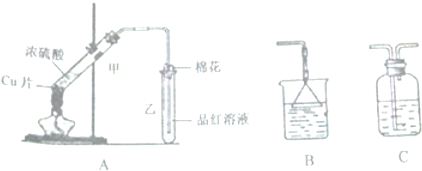
(1)试管甲发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(2)试管乙口放置的棉花浸有氢氧化钠溶液,浸有碱液的棉花的作用是吸收有毒的尾气,防止污染大气,用离子方程式表示其作用SO2+2OH-=SO32-+H2O
(3)通过试管乙中品红溶液褪色的现象,证明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有漂白性.
(4)SO2的排放是造成酸雨的主要因素,为了减少SO2的排放,工业常用生石灰在煤燃烧后的烟气脱硫,最终生成硫酸钙,其原因是亚硫酸钙中+4价S具有还原性,能被氧气氧化为硫酸钙
(5)为了防止二氧化硫造成空气污染,如果需要在末端增加尾气吸收装置,应选择的装置是B(填“B”或“C”)
(6)若实验中用7.2铜片和12.5mL18mol/L的浓硫酸在加热条件下充分反应,最终铜片仍有剩余.某同学认为溶液中一定也有硫酸剩余,其理由是反应过程中浓H2SO4被不断消耗,生成的水逐渐增多,使浓硫酸逐渐变稀,至一定浓度就不再与铜片反应.
分析 (1)浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)二氧化硫属于有毒气体,要进行尾气处理;
(3)SO2具有漂白性,可使品红溶液褪色;
(4)亚硫酸钙中+4价S具有还原性;
(5)二氧化硫的溶解度很大,用溶液吸收二氧化硫时要防倒吸;
(6)随着反应的进行,硫酸浓度不断降低,稀硫酸与铜不反应.
解答 解:(1)浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应,生成二氧化硫、硫酸铜和水,其反应的方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)二氧化硫属于有毒气体,要进行尾气处理,一般用氢氧化钠溶液吸收二氧化硫,其反应的离子方程式为:SO2+2OH-=SO32-+H2O;
故答案为:吸收有毒的尾气,防止污染大气;SO2+2OH-=SO32-+H2O;
(3)SO2具有漂白性,可使品红溶液褪色,当乙中品红褪色,说明反应中生成了二氧化硫,即Cu与浓硫酸发生反应;
故答案为:褪色;漂白;
(4)生石灰与二氧化硫反应生成亚硫酸钙,亚硫酸钙中+4价S具有还原性,在加热条件下,能被氧气氧化为硫酸钙;
故答案为:亚硫酸钙中+4价S具有还原性,能被氧气氧化为硫酸钙;
(5)为了防止二氧化硫造成空气污染,如果需要在末端增加尾气吸收装置,由于二氧化硫的溶解度很大,用溶液吸收二氧化硫时要防倒吸,所以应该选用B;
故答案为:B;
(6)浓硫酸具有强氧化性,而稀硫酸与铜不反应,随着反应的进行,硫酸浓度不断降低,稀硫酸与铜不反应,则反应后溶液中一定含有硫酸,
故答案为:反应过程中浓H2SO4被不断消耗,生成的水逐渐增多,使浓硫酸逐渐变稀,至一定浓度就不再与铜片反应..
点评 本题综合考查性实验设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握相关物质的性质以及实验原理.

已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
写出氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905.0kJ/mol.
(2)恒容密闭容器中进行的合成氨反应,其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K | 4.1×106 | K1 | K2 | … |
②上表中K1>K2(填“>”、“=”或“<”).
(3)如果向氨合成塔中充入10molN2和40molH2进行氨的合成,图A和图B为一定温度下平衡混合物中氨气的体积分数与压强(p)的关系图.
①下列说法正确的是ABD(填序号).
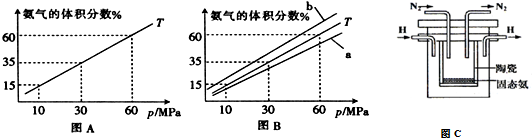
A.图中曲线表明增大体系压强(p),有利于提高氨气在混合气体中体积分数
B.如果图B中T=500℃,则温度为450℃时对应的曲线是b
C.工业上采用500℃温度可有效提高反应速率和氮气的转化率
D.当 2v正(H2)=3v逆(NH3)时,反应达到平衡状态
E.容器内混合气体密度保持不变时,反应达到平衡状态
②图A中氨气的体积分数为15%时,N2的转化率为32.61%.
(4)在1998年希腊亚里斯多德大学的Marmellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨,其实验装置如图C,则正极的电极反应式N2+6e-+6H+=2NH3.
(5)25℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11.下列说法正确的是BD.
A.25℃时,饱和Mg(OH)2溶液中c(OH-)大于饱和MgF2溶液中c(F-)
B.25℃时,某饱和Mg(OH)2溶液中c(Mg2+)=0.0561 mol•L-1,则溶液的pH=9
C. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,溶液变澄清,Ksp[Mg(OH)2]增大
D.25℃时,在Mg(OH)2悬浊液中加入NaF溶液后,Mg(OH)2可能转化为MgF2.
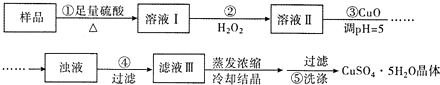
| A. | 步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O | |
| B. | 步骤②可用氯水、硝酸等强氧化剂代替H2O2 | |
| C. | 步骤③用 CuCO3代替CuO也可调节溶液的pH | |
| D. | 步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作 2~3次 |
Ⅰ.用Ⅰ1、Ⅰ2、Ⅰ3、Ⅰ4表示钪的电离能,其数据如图1.
(1)与钪同周期且含有相同未成对电子数的非金属元素为Br(填元素符号).
(2)$\frac{{I}_{2}}{{I}_{1}}$<$\frac{{I}_{4}}{{I}_{3}}$(填“>”或“<”).
(3)氯化钠晶体熔点高于氯化钾,其原因为钠离子半径小于钾离子,氯化钠晶格能大于氯化钾,所以氯化钠熔点高.
Ⅱ.提钪工艺中常用草酸法精制,草酸钪络盐的热重数据如下表:
| 草酸钪络盐 | 温度区间(K) | 质量(g) |
| Sc2(C2O4)3•6H2O | 298 | 0.462 |
| 383~423 | 0.372 | |
| 463~508 | 0.354 | |
| 583~873 | 0.138 |
(5)按草酸钪络盐失水时所克服的作用力大小不同,Sc2(C2O4)3•6H2O中的水分子可以分为2种.
(6)Sc2(C2O4)3•6H2O从583K加热到873K,断裂的化学键类型为离子键、共价键.
I.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照以下方案完成实验.
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
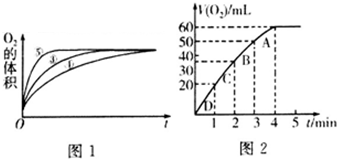
(2)实验③④⑤中,测得生成氧气的体积随时间变化的关系如图1.分析图1能够得出的实验结论是碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率.
(3)加入0.1g MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.反应速率变化的原因是H2O2溶液的浓度逐渐减小,则H2O2的初始物质的量浓度为0.11mol/L(保留两位有效数字).
Ⅱ.(1)工业上用N2和H2合成氨.已知:
N2(g)+3H2(g)?2NH3(g)△H=-a kJ•mol-1
2H2O(1)?2H2(g)+O2(g)△H=+b kJ•mol-1
则NH3被O2氧化为N2和H2O的热化学方程式为4NH3(g)+3O2(g)=2N2(g)+6H2O(1)△H=(2a-3b)kJ•mol-1.
(2)NH3能被H2O2氧化生成无毒气体和水.
①此反应可设计原电池,在碱性条件下负极的电极反应方程式为2NH3+6OH--6e-=N2+6H2O.
②利用上述原电池,用惰性电极电解l00mL 0.5mol•L-1的CuSO4溶液,电解反应的离子方程式为2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu↓+O2↑+4H+.
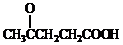 )合成聚芳酯E的路线(省略部分产物):
)合成聚芳酯E的路线(省略部分产物):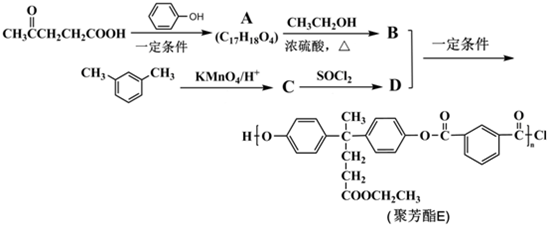
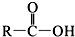 +SOCl2→
+SOCl2→ +SO2+HCl
+SO2+HCl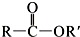 +HCl(R、R′表示烃基)
+HCl(R、R′表示烃基)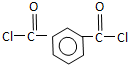 .
.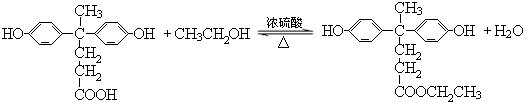 ,.
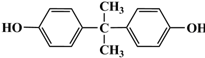
,.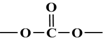 结构写出F与足量NaOH溶液共热反应的化学方程式:
结构写出F与足量NaOH溶液共热反应的化学方程式: .
. 的路线.
的路线. 日常生活中的手电筒干电池通常是锌锰电池,其构造示意图如下:
日常生活中的手电筒干电池通常是锌锰电池,其构造示意图如下: .
.
 ;
;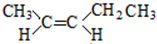 、和
、和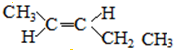 ;
; .
.