题目内容
1.如表是元素周期表的一部分,针对表中的A-J种元素,填写下列空白.| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | A | B | C | |||||
| 3 | D | E | F | G | H | |||
| 4 | I | J |
(2)在最高价氧化物的水合物中,酸性最强的化合物的化学式是HClO4,它与碱性最强的化合物反应的离子方程式为H++OH-=H2O.
(3)C与D按原子个数比1:1形成的化合物的电子式为
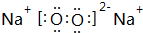 ,该化合物是由离子和共价键形成.
,该化合物是由离子和共价键形成.(4)某同学做同周期元素D、E、F、G、H性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见如表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
| 实验步骤 | 实验现象 |
| ①将E单质用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | 1.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制的Na2G溶液中滴加新制的单质H的水溶液 | 2.有气体产生,溶液变成浅红色 |
| ③将一小块金属D放入滴有酚酞溶液的冷水中 | 3.剧烈反应,迅速产生大量无色气体. |
| ④将单质E投入稀盐酸中 | 4.反应开始不十分剧烈,产生无色气体. |
| ⑤将单质F投入稀盐酸中 | 5.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向FH3溶液中滴加DOH溶液至过量 | 6.生成淡黄色沉淀. |
实验内容:
实验②、实验④所对应的实验现象分别为6、3(填序号)
实验⑥中发生反应的离子方程式为Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O;
实验结论:从左到右同周期元素原子的失电子能力递减,得电子能力递增.
分析 由元素在周期表中位置,可知A为碳、B为氮、C为氧、D为Na、E为Mg、F为Al、G为硫、H为Cl、I为钾、J为Br.
(1)由元素位置可知,J位于第四周期VⅡA族;
(2)在最高价氧化物的水合物中,酸性最强的是高氯酸,碱性最强的是KOH,二者发生中和反应生成KClO4与水;
(3)C与D按原子个数比1:1形成的化合物为Na2O2,由钠离子与过氧根离子构成,过氧根离子中氧原子之间形成共价键;
(4)实验②发生反应:Na2S+Cl2=2NaCl+S↓;
实验④镁较铝活泼,但都能与盐酸发生置换反应,将镁条投入稀盐酸中,剧烈反应,迅速产生大量无色气体;
实验⑥向A1Cl3溶液中滴加NaOH溶液至过量,先生成Al(OH)3沉淀,进而与NaOH反应生成溶于水的NaAlO2;
根据实验现象比较金属性、非金属性的强弱,归纳同周期元素性质的递变规律.
解答 解:由元素在周期表中位置,可知A为碳、B为氮、C为氧、D为Na、E为Mg、F为Al、G为硫、H为Cl、I为钾、J为Br.
(1)由元素位置可知,J位于第四周期VⅡA族,故答案为:第四周期VⅡA族;
(2)在最高价氧化物的水合物中,酸性最强的是HClO4,碱性最强的是KOH,二者发生中和反应生成KClO4与水,反应离子方程式为:H++OH-=H2O,故答案为:HClO4;H++OH-=H2O;
(3)C与D按原子个数比1:1形成的化合物为Na2O2,由钠离子与过氧根离子构成,电子式为 ,由离子键、共价键形成,
,由离子键、共价键形成,
故答案为: ;离子和共价;
;离子和共价;
(4)①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾,镁与热水反应生成氢气,有气泡产生,反应生成氢氧化镁,溶液呈碱性,再向溶液中滴加酚酞溶液,溶液呈红色,反应为:MgCl2+2H2O=Mg(OH)2↓+H2↑;
②向新制得的Na2S溶液中满加新制的氯水,氯气与Na2S发生氧化还原反应,反应的化学方程式为Na2S+Cl2=2NaCl+S↓,生成淡黄色沉淀;
③因钠的密度比水小,与水剧烈反应生成氢气和氢氧化钠,氢氧化钠遇酚酞变红,同时反应放热,所以钠浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色;
④镁较铝活泼,但都能与盐酸发生置换反应,将镁条投入稀盐酸中,剧烈反应,迅速产生大量无色气体,
⑤将铝条投入稀盐酸中,较镁不活泼,反应不十分剧烈,产生无色气体;
⑥向A1Cl3溶液中滴加NaOH溶液至过量,先生成Al(OH)3沉淀,进而与NaOH反应生成溶于水的NaAlO2,反应的离子方程式为:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O,
由金属与水、酸反应剧烈程度,可知金属性Na>Mg>Al,非金属元素单质的相互置换反应,可知非金属性S<Cl,可以得出:从左到右同周期元素原子的失电子能力递减,得电子能力递增,
故答案为:6、3;Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O;从左到右同周期元素原子的失电子能力递减,得电子能力递增.
点评 本题考查元素周期表与元素周期律、同周期元素性质的递变规律实验的探究,题目难度不大,培养了学生分析和解决问题的能力.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案| A. | 乙醇的水溶液可使蛋白质发生性质改变 | |
| B. | 纤维素在一定条件下水解生成葡萄糖 | |
| C. | 在一定条件下油脂水解可生成甘油 | |
| D. | 煤的干馏、石油的分馏都属于化学变化 |
| A. | 分子式为C5H12的烃有三种可能的结构 | |
| B. | 乙烯和聚乙烯均能和溴水发生加成反应而使溴水褪色 | |
| C. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| D. | 淀粉、纤维素和蛋白质都是高分子化合物,它们在一定条件下都能水解 |
| A. | 电池放电时,负极上发生反应的物质是Ag2O | |
| B. | 电池放电时,正极发生氧化反应 | |
| C. | 电池充电时,阳极上发生反应的物质是Ag | |
| D. | 电池充电时,阴极上发生氧化反应 |
| A. | 将SO2通入品红溶液或者溴水都能使它们褪色,均说明SO2具有漂白性 | |
| B. | 蘸有浓氨水和蘸有浓HNO3的玻璃棒靠近时有白烟产生,是因为氨气有还原性 | |
| C. | 某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,说明溶液中一定没有NH4+ | |
| D. | NH3•H2O的热不稳定性可以解释实验室中用加热氨水的办法制取氨气 |
| A. | pH=7的溶液 | B. | 使石蕊试液呈紫色的溶液 | ||
| C. | c(H+)=c(OH-)=10-6mol•L-1的溶液 | D. | 酸与碱恰好反应生成的溶液 |
| A. | 原电池是利用氧化还原反应将化学能转化成电能的装置 | |
| B. | 金属A与B用导线连接后插入稀硫酸中组成原电池时,A是正极,则B的金属性强于A | |
| C. | 化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变 | |
| D. | 对于反应N2(g)+3H2(g)?2NH3(g),单位时间里每增加1molN2,同时增加3molH2,说明反应到化学平衡状态 |
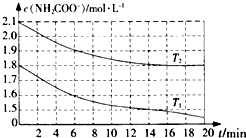 科学研究小组对氨基甲酸铵(NH2COONH4)的分解和水解反应进行探究.
科学研究小组对氨基甲酸铵(NH2COONH4)的分解和水解反应进行探究.