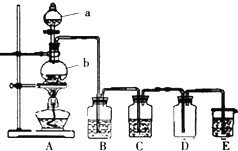
题目内容
13. 科学研究小组对氨基甲酸铵(NH2COONH4)的分解和水解反应进行探究.
科学研究小组对氨基甲酸铵(NH2COONH4)的分解和水解反应进行探究.(1)25℃时,将NH2COON4固体置于体积恒定的密闭真空容器中,发生分解反应.NH2COONH4(s)?2NH3(g)+C02(g)
①该反应的平衡常数表达式K=[NH3]2•[C02].
②下列能判断该反应已达到化学平衡的标志是AC.
A.v正(NH3)=2v逆(CO2) B.容器中混合气体的体积不变
C.容器内压强不变 D.容器中氨气的体积分数不变
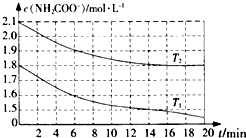
(2)氨基甲酸铵易水解,NH2COONH4+2H2O?NH4HCO3+NH3•H2O.该研究小组在温度T1、T2(T1≠T2)下,测定两份不同浓度氨基甲酸铵溶液的水解反应速率,得到c(NH2COO-)随时间的变化曲线如图所示.
①温度T1时,0~6min氨基甲酸铵水解率为11.11%(保留到小数点后2位,下同); NH2COO-平均水解速率为0.03mol/(L•min).
②据图判断T1>T2(填“>”、“<”“=”),理由为在0~6min时段,T1、T2反应速率相同,但是温度T2的起始浓度大于T1,说明温度T1>T2.
(3)制取氨基甲酸铵需氨气.近年,科学家提出:在常温、常压、催化剂等条件下,由空气中N2与H2O合成NH3的新思路.
已知:
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6lkJ•mol-1
请写出N2与H2O合成NH3的热化学方程式2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1530 kJ•mol-1.
分析 (1)①根据反应NH2COONH4(s)?2NH3(g)+C02(g)及平衡常数的概念写出该反应的平衡常数表达式;
②达到平衡状态特征时,正逆反应速率相等,各组分浓度不再变化,据此进行判断;
(2)①温度T1时,0~6min氨基甲酸铵分解了(1.8-1.6)mol/L=0.2mol/L,据此计算分解率;根据v=$\frac{△c}{△t}$计算NH2COO-平均水解速率;
②根据在0~6min时段,T1、T2反应速率相同,但是温度T2的起始浓度大于T1进行判断;
(3)已知:①N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1,②2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,
由盖斯定律:①×2-②×3得2N2(g)+6H2O(l)?4NH3(g)+3O2(g),据此分析.
解答 解:(1)①NH2COONH4(s)?2NH3(g)+C02(g)的平衡常数表达式K=[NH3]2•[C02],
故答案为:[NH3]2•[C02];
②A.v正(NH3)=2v逆(CO2),证明正逆反应速率相等,达到了平衡状态,故A正确;
B.容器中混合气体的体积不变:由于容器的容积不变,则混合气体的总体积不变,无法判断是否达到平衡状态,故B错误;
C.容器内压强不变,说明混合气体的物质的量不再变化,则正逆反应速率相等,达到了平衡状态,故C正确;
D.反应中氨气和二氧化碳的体积之比为2:1,则容器中氨气的体积分数始终不变,无法判断是否达到平衡状态,故D错误;
故答案为:AC;
(2)①根据图象可知,温度T1时,0~6min氨基甲酸铵分解了(1.8-1.6)mol/L=0.2mol/L,则其分解率为:$\frac{0.2mol/L}{1.8mol/L}$×100%≈11.11%;
NH2COO-平均水解速率为:v=$\frac{0.2mol/L}{6min}$=0.03mol/(L•min),
故答案为:11.11%;0.03mol/(L•min);
②图象中纵坐标为c(NH2COO-),横坐标为时间,在0~6min时段,T1、T2反应速率相同,但是温度T2的起始浓度大于T1,说明温度T1>T2,
故答案为:>;在0~6min时段,T1、T2反应速率相同,但是温度T2的起始浓度大于T1,说明温度T1>T2;
(3)已知:①N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1,
②2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1,
由盖斯定律:①×2-②×3得2N2(g)+6H2O(l)=4NH3(g)+3O2(g),△H=(-92.4kJ•mol-1)×2-(-571.6kJ•mol-1)×3=+1530 kJ•mol-1,
故答案为:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=+1530 kJ•mol-1.
点评 本题考查了化学平衡状态的判断、化学反应速率的计算、热化学方程式的计算,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学计算能力,注意明确盖斯定律的含义及应用方法,熟练掌握化学平衡状态的判断方法.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案| A. | $\frac{a+b}{5}×100%$ | B. | $\frac{2(a+b)}{5b}×100%$ | C. | $\frac{2(a+b)}{5}×100%$ | D. | $\frac{a+b}{5a}×100%$ |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | A | B | C | |||||
| 3 | D | E | F | G | H | |||
| 4 | I | J |
(2)在最高价氧化物的水合物中,酸性最强的化合物的化学式是HClO4,它与碱性最强的化合物反应的离子方程式为H++OH-=H2O.
(3)C与D按原子个数比1:1形成的化合物的电子式为
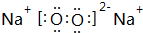 ,该化合物是由离子和共价键形成.
,该化合物是由离子和共价键形成.(4)某同学做同周期元素D、E、F、G、H性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见如表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
| 实验步骤 | 实验现象 |
| ①将E单质用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | 1.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制的Na2G溶液中滴加新制的单质H的水溶液 | 2.有气体产生,溶液变成浅红色 |
| ③将一小块金属D放入滴有酚酞溶液的冷水中 | 3.剧烈反应,迅速产生大量无色气体. |
| ④将单质E投入稀盐酸中 | 4.反应开始不十分剧烈,产生无色气体. |
| ⑤将单质F投入稀盐酸中 | 5.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向FH3溶液中滴加DOH溶液至过量 | 6.生成淡黄色沉淀. |
实验内容:
实验②、实验④所对应的实验现象分别为6、3(填序号)
实验⑥中发生反应的离子方程式为Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O;
实验结论:从左到右同周期元素原子的失电子能力递减,得电子能力递增.
| A. | 1:2:3 | B. | 3:2:1 | C. | 6:3:1 | D. | 6:3:2 |
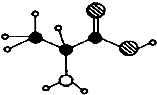
| A. | 能与浓硝酸作用显黄色 | |
| B. | 在一定条件下,可以发生聚合反应生成高分子化合物 | |
| C. | 与盐酸不反应 | |
| D. | 与NaHCO3溶液不反应 |
| A. | 钙离子的结构示意图: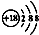 | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | CH4分子的球棍模型: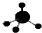 | D. | -CH3(甲基)的电子式为: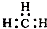 |
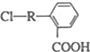 (其中R为饱和烃基),X在一定条件下如图所示的转化关系,已知Q的蒸气密度是相同条件下H2密度的74倍,分子组成符号CaHbO2
(其中R为饱和烃基),X在一定条件下如图所示的转化关系,已知Q的蒸气密度是相同条件下H2密度的74倍,分子组成符号CaHbO2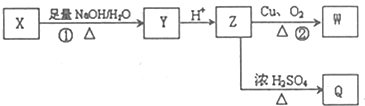
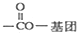 ),写出任意一种能发生银镜反应的符合上述条件的物质的结构简式
),写出任意一种能发生银镜反应的符合上述条件的物质的结构简式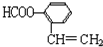
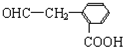 .于由X通过一步反应得到P,该反应的化学方程式是
.于由X通过一步反应得到P,该反应的化学方程式是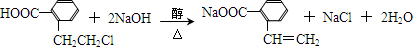
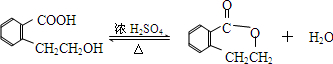 .
.