题目内容
6.下列溶液一定呈中性的是( )| A. | pH=7的溶液 | B. | 使石蕊试液呈紫色的溶液 | ||
| C. | c(H+)=c(OH-)=10-6mol•L-1的溶液 | D. | 酸与碱恰好反应生成的溶液 |
分析 温度未知时,根据溶液中c(H+)、c(OH-)相对大小判断溶液酸碱性,如果c(H+)=c(OH-),则溶液呈中性,如果c(H+)>c(OH-),则溶液呈酸性,如果c(H+)<c(OH-),则溶液呈碱性,据此分析解答.
解答 解:A.pH=7的溶液不一定呈中性,可能呈酸性或碱性,100℃时纯水的pH=6,该温度下pH=7时溶液呈碱性,故A错误;
B.石蕊试液变色范围是5-8,则石蕊试液呈紫色的溶液呈酸性,故B错误;
C.无论温度多少,只要溶液中存在c(H+)=c(OH-),则该溶液一定呈中性,所以c(H+)=c(OH-)=10-6mol•L-1的溶液呈中性,故C正确;
D.酸与碱恰好反应生成的溶液可能呈酸性或碱性,如氯化铵溶液呈酸性、碳酸钠溶液呈碱性,故D错误;
故选C.
点评 本题考查溶液酸碱性判断,要根据溶液中c(H+)、c(OH-)相对大小判断溶液酸碱性,温度未知时不能根据溶液pH判断酸碱性,为易错题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.将等质量四块铜片在酒精灯上加热后,分别插人下列溶液中,放置片刻后铜片质量与加热前相同的是( )
| A. | 氨水 | B. | 乙醇 | C. | 醋酸 | D. | 硝酸 |
14.化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
| A. | 氮氧化合物与碳氢化合物经紫外线照射可发生反应形成有毒烟雾 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 雾霾中含有大量超标的主要物质是二氧化硫 | |
| D. | 用铝制的容器盛装浓硝酸,是因为铝和浓HNO3不反应 |
1.如表是元素周期表的一部分,针对表中的A-J种元素,填写下列空白.
(1)元素J在周期表中的位置第四周期VⅡA族.
(2)在最高价氧化物的水合物中,酸性最强的化合物的化学式是HClO4,它与碱性最强的化合物反应的离子方程式为H++OH-=H2O.
(3)C与D按原子个数比1:1形成的化合物的电子式为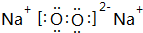 ,该化合物是由离子和共价键形成.
,该化合物是由离子和共价键形成.
(4)某同学做同周期元素D、E、F、G、H性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见如表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
请你帮助该同学整理并完成实验报告.
实验内容:
实验②、实验④所对应的实验现象分别为6、3(填序号)
实验⑥中发生反应的离子方程式为Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O;
实验结论:从左到右同周期元素原子的失电子能力递减,得电子能力递增.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | A | B | C | |||||
| 3 | D | E | F | G | H | |||
| 4 | I | J |
(2)在最高价氧化物的水合物中,酸性最强的化合物的化学式是HClO4,它与碱性最强的化合物反应的离子方程式为H++OH-=H2O.
(3)C与D按原子个数比1:1形成的化合物的电子式为
 ,该化合物是由离子和共价键形成.
,该化合物是由离子和共价键形成.(4)某同学做同周期元素D、E、F、G、H性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见如表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
| 实验步骤 | 实验现象 |
| ①将E单质用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | 1.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制的Na2G溶液中滴加新制的单质H的水溶液 | 2.有气体产生,溶液变成浅红色 |
| ③将一小块金属D放入滴有酚酞溶液的冷水中 | 3.剧烈反应,迅速产生大量无色气体. |
| ④将单质E投入稀盐酸中 | 4.反应开始不十分剧烈,产生无色气体. |
| ⑤将单质F投入稀盐酸中 | 5.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向FH3溶液中滴加DOH溶液至过量 | 6.生成淡黄色沉淀. |
实验内容:
实验②、实验④所对应的实验现象分别为6、3(填序号)
实验⑥中发生反应的离子方程式为Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O;
实验结论:从左到右同周期元素原子的失电子能力递减,得电子能力递增.
11.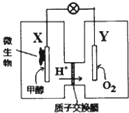 某酸性介质的甲醇微生物电池,是一种利用微生物将化学能直接转化成电能的装置.下列叙述正确的是( )
某酸性介质的甲醇微生物电池,是一种利用微生物将化学能直接转化成电能的装置.下列叙述正确的是( )
 某酸性介质的甲醇微生物电池,是一种利用微生物将化学能直接转化成电能的装置.下列叙述正确的是( )
某酸性介质的甲醇微生物电池,是一种利用微生物将化学能直接转化成电能的装置.下列叙述正确的是( )| A. | 电子从Y电极流向X电极 | |
| B. | 02在Y电极上发生氧化反应 | |
| C. | X电极的电极反应为:CH3OH+H2O-6e-═CO2↑+6H+ | |
| D. | 若1mol电子在导线中通过,则有2mol的H+通过质子交换膜 |
18.下图M只含C、H、0、N 4种元索的有机物分子球棍模型.下列关于该有机物的说法正确的是( )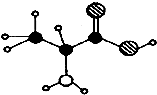

| A. | 能与浓硝酸作用显黄色 | |
| B. | 在一定条件下,可以发生聚合反应生成高分子化合物 | |
| C. | 与盐酸不反应 | |
| D. | 与NaHCO3溶液不反应 |
15.如图是制取和收集某气体的实验装置,该装置可用于( )
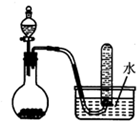

| A. | 浓盐酸和二氧化锰反应制取Cl2 | B. | 稀硫酸和大理石反应制取CO2 | ||
| C. | 浓硝酸与铜反应制取NO2 | D. | 二氧化锰固体和双氧水反应制取O2 |
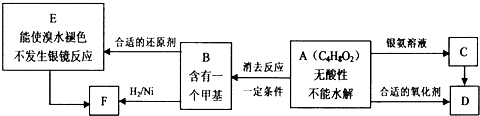
 .
.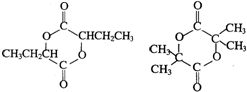 .
. +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$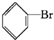 +HBr.
+HBr.