题目内容
16.下列实验的原理分析中,正确的是( )| A. | 将SO2通入品红溶液或者溴水都能使它们褪色,均说明SO2具有漂白性 | |
| B. | 蘸有浓氨水和蘸有浓HNO3的玻璃棒靠近时有白烟产生,是因为氨气有还原性 | |
| C. | 某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,说明溶液中一定没有NH4+ | |
| D. | NH3•H2O的热不稳定性可以解释实验室中用加热氨水的办法制取氨气 |
分析 A、SO2和Br2、H2O反应,是二氧化硫的还原性,不是二氧化硫的漂白性;
B、浓氨水具有挥发性和碱性;
C、溶液中可能含有氢离子等与氢氧根离子反应.氨气极易溶于水,稀溶液中,铵根离子与氢氧化钠反应,不加热,不能产生氨气;
D、一水合氨不稳定,加热促进分解.
解答 解:A.二氧化硫气体通入溴水中发生氧化还原反应SO2+Br2+2H2O=H2SO4+2HBr,红棕色退去,体现了二氧化硫的还原性,故A错误;
B、有白烟产生说明生成氯化铵固体颗粒,体现浓氨水具有挥发性和碱性,故B错误;
C、溶液中可能含有氢离子等,优先与氢氧根离子反应,铵根离子不能反应.氨气极易溶于水,稀溶液中,铵根离子与氢氧化钠反应,不加热,不能产生氨气,故不能说明原溶液中是否含有NH4+,故C错误;
D、氨水不稳定,在加热条件下能分解生成氨气,所以可用加热氨水的方法制取氨气,故D正确.
故选D.
点评 本题考查离子检验、氨水和二氧化硫的性质,难度中等,掌握常见离子检验方法,C选项注意干扰离子的影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)═PCl3(g)+Cl2(g),经过一段时间后达到平衡.反应过程中测定的t/s-n(PCl3)/mol数据如图.下列说法正确的是( )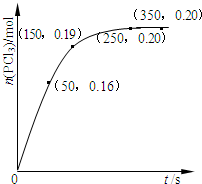

| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) | |
| C. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| D. | 相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% |
11.向盛有白糖的小烧杯中加几滴水搅拌均匀,在滴入浓硫酸,白糖变黑,并迅速膨大,俗称“黑面包”,同时又气体逸出,若将该气体通入澄清石灰水中,有白色沉淀生成,下列叙述中不正确的是( )
| A. | 浓硫酸的作用,脱水剂、强氧化剂 | B. | “黑面包”的主要成分:C | ||
| C. | 气体的主要成分:SO2、CO2 | D. | 白色沉淀只有CaCO3 |
1.如表是元素周期表的一部分,针对表中的A-J种元素,填写下列空白.
(1)元素J在周期表中的位置第四周期VⅡA族.
(2)在最高价氧化物的水合物中,酸性最强的化合物的化学式是HClO4,它与碱性最强的化合物反应的离子方程式为H++OH-=H2O.
(3)C与D按原子个数比1:1形成的化合物的电子式为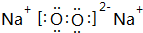 ,该化合物是由离子和共价键形成.
,该化合物是由离子和共价键形成.
(4)某同学做同周期元素D、E、F、G、H性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见如表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
请你帮助该同学整理并完成实验报告.
实验内容:
实验②、实验④所对应的实验现象分别为6、3(填序号)
实验⑥中发生反应的离子方程式为Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O;
实验结论:从左到右同周期元素原子的失电子能力递减,得电子能力递增.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | A | B | C | |||||
| 3 | D | E | F | G | H | |||
| 4 | I | J |
(2)在最高价氧化物的水合物中,酸性最强的化合物的化学式是HClO4,它与碱性最强的化合物反应的离子方程式为H++OH-=H2O.
(3)C与D按原子个数比1:1形成的化合物的电子式为
 ,该化合物是由离子和共价键形成.
,该化合物是由离子和共价键形成.(4)某同学做同周期元素D、E、F、G、H性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见如表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
| 实验步骤 | 实验现象 |
| ①将E单质用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | 1.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制的Na2G溶液中滴加新制的单质H的水溶液 | 2.有气体产生,溶液变成浅红色 |
| ③将一小块金属D放入滴有酚酞溶液的冷水中 | 3.剧烈反应,迅速产生大量无色气体. |
| ④将单质E投入稀盐酸中 | 4.反应开始不十分剧烈,产生无色气体. |
| ⑤将单质F投入稀盐酸中 | 5.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向FH3溶液中滴加DOH溶液至过量 | 6.生成淡黄色沉淀. |
实验内容:
实验②、实验④所对应的实验现象分别为6、3(填序号)
实验⑥中发生反应的离子方程式为Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O;
实验结论:从左到右同周期元素原子的失电子能力递减,得电子能力递增.
8.在一定条件下,将分別盛有熔融氯化钾、氯化镁、氧化铝的三个电解槽串联、通电、电解,一段时间后,得到钾、镁、铝的物质的量之比为( )
| A. | 1:2:3 | B. | 3:2:1 | C. | 6:3:1 | D. | 6:3:2 |
6.下列有关判断正确的是( )
| A. | 反应C(s)+CO2(g)═2CO(g)的△H>0,△S<0 | |
| B. | 反应H+(aq)+OH-(aq)═H2O(l)的△H<0,△S<0 | |
| C. | 反应NH3(g)+HCl(g)═NH4Cl(s) 在低温下能自发进行,则该反应△H>0 | |
| D. | 反应CaCO3(s)═CaO(s)+CO2(g) 室温下不能自发进行,则该反应△H<0 |
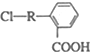 (其中R为饱和烃基),X在一定条件下如图所示的转化关系,已知Q的蒸气密度是相同条件下H2密度的74倍,分子组成符号CaHbO2
(其中R为饱和烃基),X在一定条件下如图所示的转化关系,已知Q的蒸气密度是相同条件下H2密度的74倍,分子组成符号CaHbO2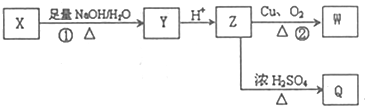
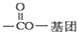 ),写出任意一种能发生银镜反应的符合上述条件的物质的结构简式
),写出任意一种能发生银镜反应的符合上述条件的物质的结构简式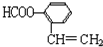
 .于由X通过一步反应得到P,该反应的化学方程式是
.于由X通过一步反应得到P,该反应的化学方程式是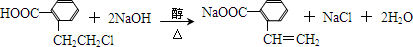
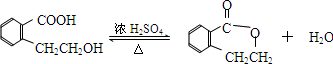 .
.