题目内容
19.下列冶炼方法中,不能将化合物中的金属元素还原为金属单质的是( )| A. | 加热Al2O3 | B. | 加热HgO | C. | 电解熔融NaCl | D. | 铝粉和Fe2O3共热 |
分析 根据金属的活泼性强弱冶炼金属,K、Ca、Na、Mg、Al等金属用电解法,Zn、Fe、Sn、Pb、Cu等金属用热还原法、Hg、Ag等金属用热分解法冶炼.
解答 解:A.氧化铝的熔点很高,加热氧化氯不会获得金属铝,故A选;
B.加热氧化汞会发生分解,制的金属Hg,故B不选;
C.Na为活泼金属,应用电解熔融NaCl的方法冶炼,故C不选;
D.铝粉和Fe2O3共热反应可以得到金属铁和氧化铝,故D不选.
故选A.
点评 本题考查金属的冶炼,注意常见金属的冶炼方法,把握金属的活泼性强弱,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.在下列各溶液中,离子一定能大量共存的是( )
| A. | 能使紫色石蕊试液变红的溶液中:Fe2+、Na+、SO42-、NO3- | |
| B. | 碱性溶液中:Na+、K+、NO3-、ClO- | |
| C. | pH=1的溶液中:Na+、Cu2+、Cl-、S2- | |
| D. | 加入Al能放出氢气的溶液中:NH4+、SO42-、NO3-、ClO- |
14.下列叙述错误的是( )
| A. | 氧化铁常用作红色油漆和涂料 | |
| B. | 司母戊鼎是青铜制品 | |
| C. | 光导纤维的主要成分是硅酸盐 | |
| D. | 常温下可用铁制或铝制容器盛装浓硫酸 |
1.聚合硫酸铁(PFS)是一种重要的无机高分子絮凝剂,在工业和生活污水处理等领域具有重要应用.PFS可表示成Fex(OH)y(SO4)z(其中铁元素化合价为+3),工业上常用绿矾等原料制备,采用“一锅法”制备PFS的工艺流程如下.
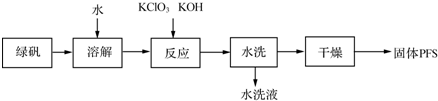
(1)从上述流程判断,水洗液中可以回收的主要物质有KCl、K2SO4.
(2)绿矾溶液与KClO3、KOH发生反应,其中还原剂与氧化剂的物质的量之比为6:1.
(3)下表是PFS的三种生产工艺所使用的原料.
试分析“一锅法”工艺的优点是未使用硫酸,不腐蚀设备,选择表中的一种方案分析其可能的缺点双氧水法:反应放热,双氧水分解(或次氯酸钠法:产生氯气,污染环境或硝酸氧化法:产生NO2等氮氧化物污染环境).
(4)在PFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=$\frac{n(O{H}^{-})}{3n(Fe)}$×100%,式中n(OH-)、n(Fe)分别表示聚合硫酸铁中OH-和Fe的物质的量.取7.51g某聚合硫酸铁溶解于稀盐酸,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48g;再向上述滤液中加入足量NH3•H2O,经过滤、洗涤、干燥、灼烧得Fe2O3固体2.80g.试计算该固体聚合硫酸铁的盐基度.

(1)从上述流程判断,水洗液中可以回收的主要物质有KCl、K2SO4.
(2)绿矾溶液与KClO3、KOH发生反应,其中还原剂与氧化剂的物质的量之比为6:1.
(3)下表是PFS的三种生产工艺所使用的原料.
| 方法 | 双氧水氧化法 | 次氯酸钠氧化法 | 硝酸氧化法 |
| 原料 | 绿矾、硫酸、双氧水 | 绿矾、硫酸、次氯酸钠 | 绿矾、硫酸、浓硝酸等 |
(4)在PFS的多个质量指标中,盐基度是重要的质量指标之一,盐基度定义为:盐基度=$\frac{n(O{H}^{-})}{3n(Fe)}$×100%,式中n(OH-)、n(Fe)分别表示聚合硫酸铁中OH-和Fe的物质的量.取7.51g某聚合硫酸铁溶解于稀盐酸,向其中加入过量的BaCl2溶液到沉淀完全,经过滤、洗涤、干燥得白色沉淀10.48g;再向上述滤液中加入足量NH3•H2O,经过滤、洗涤、干燥、灼烧得Fe2O3固体2.80g.试计算该固体聚合硫酸铁的盐基度.
18.已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )


| A. | 形成产物C和D的化学键放出的总能量高于断开反应物A和B的化学键所吸收的总能量 | |
| B. | 该反应只有在加热条件下才能进行 | |
| C. | 反应物的总能量高于产物的总能量 | |
| D. | 该反应为吸热反应 |
19.常温下,实验室有0.01mol•L-1醋酸,下列叙述正确的是( )
| A. | c(CH3COO-)+c(OH-)=0.01 mol•L-1 | |
| B. | 与等体积pH=12的氨水混合后所得溶液显酸性 | |
| C. | 加入少量醋酸钠固体后所得溶液中c(CH3COO-)减小 | |
| D. | 与等体积0.01 mol•L-1NaNO3溶液混合后有:c(NO3-)=c(CH3COO-)+c(CH3COOH) |
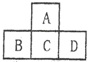 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在周期表中的位置如图所示.E元素的最高价氧化物既能与强酸反应又能与强碱反应.请回答:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在周期表中的位置如图所示.E元素的最高价氧化物既能与强酸反应又能与强碱反应.请回答: ,.
,.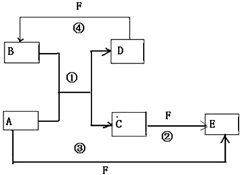 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出)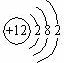 .反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O
.反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O