题目内容
7.将一定质量的Fe、Fe2O3和CuO的混合粉末加入到100mL4.4mol/L的盐酸中,充分反应后,生成标准状况下的氢气896mL.过滤,滤渣经洗涤、干燥后称量,质量为1.28g,滤液中的溶质只有FeCl2和HCl,滤液加水稀释到320mL时,盐酸的浓度为0.25mol/L.请回答:(1)计算生成氢气的物质的量为0.04mol;
(2)计算原混合物中铁单质的质量(写出计算过程)
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算生成氢气的物质的量;
(2)混合物与盐酸反应后,盐酸有剩余,则残留物没有Fe,只有Cu,滤液中含有剩余的HCl及FeCl2,根据Cl原子守恒n总(HCl)=n剩余(HCl)+2n(FeCl2),据此计算n(FeCl2),设原有Fe为xmol,Fe2O3为ymol,根据Fe元素守恒和电子转移守恒列方程计算解答.
解答 解:(1)生成标准状况下的氢气896mL,其物质的量为$\frac{0.896L}{22.4L/mol}$=0.04mol,
故答案为:0.04;
(2)混合物与盐酸反应后,盐酸有剩余,则残留物没有Fe,只有Cu,滤液中含有剩余的HCl及FeCl2,
根据Cl原子守恒:n总(HCl)=n剩余(HCl)+2n(FeCl2),即0.1L×4.4mol/L=0.32L×0.25mol/L+2n(FeCl2),解得n(FeCl2)=0.18mol,
n(CuO)=n(Cu)=$\frac{1.28g}{64g/mol}$=0.02mol,
设原有Fe为xmol,Fe2O3为ymol,
由Fe元素守恒,可得:x+2y=0.18,
根据电子转移守恒,可得:2x=2y+2×0.02+2×0.04,
联立方程,解得:x=0.1 y=0.04,
原混合物中单质铁的质量56g/mol×0.1mol=5.6g,
答:原混合物中Fe单质的质量为5.6g.
点评 本题考查混合物的计算,题目难度中等,根据滤液中溶质判断残留物为铜,再利用守恒法计算,侧重考查学生分析计算能力.

练习册系列答案
相关题目
18.第ⅠA族的两种元素的原子序数之差不可能是( )
| A. | 16 | B. | 26 | C. | 36 | D. | 46 |
15.某溶液中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Fe2+、Cl-、Br-、I-的个数比为5:4:3:4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为4:1,则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为( )
| A. | 6:1 | B. | 5:1 | C. | 7:1 | D. | 4:1 |
2.瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图,有关说法正确的是( )


| A. | 电池工作时,Na+向负极移动 | |
| B. | 通氨气的电极1作电池的正极 | |
| C. | 电子由电极2经外电路流向电极1 | |
| D. | 燃料电池的总反应为:4NH3+3O2=2N2+6H2O |
12.从甜橙的芳香油中可分离得到如右图结构的化合物: ,能与该化合物中所有官能团都发生反应的试剂有( )
,能与该化合物中所有官能团都发生反应的试剂有( )
 ,能与该化合物中所有官能团都发生反应的试剂有( )
,能与该化合物中所有官能团都发生反应的试剂有( )| A. | 酸性KMnO4溶液 | B. | Ag(NH3)2OH溶液 | C. | 新制Cu(OH)2悬浊液 | D. | H2/Ni |
19.下列冶炼方法中,不能将化合物中的金属元素还原为金属单质的是( )
| A. | 加热Al2O3 | B. | 加热HgO | C. | 电解熔融NaCl | D. | 铝粉和Fe2O3共热 |
7.下列依据相关实验得出的结论正确的是( )
| 编号 | 实验 | 结论 |
| A | 向某溶液中加入稀盐酸,将产生的气体通入澄清石灰水,石灰水变浑浊 | 该溶液一定是碳酸盐溶液 |
| B | 用铂丝蘸取少量某溶液在酒精灯火焰上进行焰色反应,火焰呈黄色 | 该溶液不一定是钠盐溶液 |
| C | 往淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液并水浴加热,无银镜出现 | 该淀粉未发生水解 |
| D | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色 | 该溶液中一定含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
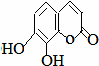 瑞香是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示,回答下列问题.
瑞香是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示,回答下列问题. 硫酸钠与工农业生产、生活紧密相关,工业硫酸钠大多采用侯氏制碱法制取.
硫酸钠与工农业生产、生活紧密相关,工业硫酸钠大多采用侯氏制碱法制取.