题目内容
19.常温下,实验室有0.01mol•L-1醋酸,下列叙述正确的是( )| A. | c(CH3COO-)+c(OH-)=0.01 mol•L-1 | |
| B. | 与等体积pH=12的氨水混合后所得溶液显酸性 | |
| C. | 加入少量醋酸钠固体后所得溶液中c(CH3COO-)减小 | |
| D. | 与等体积0.01 mol•L-1NaNO3溶液混合后有:c(NO3-)=c(CH3COO-)+c(CH3COOH) |
分析 A.醋酸为弱酸,溶液中部分电离出氢离子,则氢离子浓度小于0.01mol/L,再结合电荷守恒判断;
B.一水合氨为弱碱,pH=12的氨水的浓度大于0.01mol/L,则混合液中氨水过量,混合液为碱性;
C.加入醋酸钠后,醋酸的电离程度减小,但是溶液中醋酸根离子浓度增大;
D.结合混合液中的物料守恒判断.
解答 解:A.0.01mol/L的醋酸溶液中,氢离子浓度一定小于0.01mol/L,根据电荷守恒可知:c(CH3COO-)+c(OH-)=c(H+)<0.01 mol•L-1,故A错误;
B.0.01mol•L-1醋酸与等体积pH=12的氨水混合后,常温下pH=12的氨水的浓度大于0.01mol/L,则氨水过量,混合液呈碱性,故B错误;
C.加入少量醋酸钠固体后,醋酸的电离程度会减小,但c(CH3COO-)增大,故C错误;
D.与等体积0.01 mol•L-1NaNO3溶液混合后,根据物料守恒可得:c(NO3-)=0.005mol/L=c(CH3COO-)+c(CH3COOH),故D正确;
故选D.
点评 本题考查了离子浓度大小比较、溶解度在的电离及其影响,题目难度中等,明确弱电解质的电离及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义及应用,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
19.下列冶炼方法中,不能将化合物中的金属元素还原为金属单质的是( )
| A. | 加热Al2O3 | B. | 加热HgO | C. | 电解熔融NaCl | D. | 铝粉和Fe2O3共热 |
10.下列说法不正确的是( )
| A. | 仅用酸性高锰酸钾溶液可区分苯和甲苯 | |
| B. | 仅用氯化铁溶液可区分苯酚稀溶液和甘油 | |
| C. | 仅用硝酸银溶液可验证卤代烃中卤原子的种类 | |
| D. | 仅用溴的四氯化碳溶液可区别液态的植物油和动物油 |
7.下列依据相关实验得出的结论正确的是( )
| 编号 | 实验 | 结论 |
| A | 向某溶液中加入稀盐酸,将产生的气体通入澄清石灰水,石灰水变浑浊 | 该溶液一定是碳酸盐溶液 |
| B | 用铂丝蘸取少量某溶液在酒精灯火焰上进行焰色反应,火焰呈黄色 | 该溶液不一定是钠盐溶液 |
| C | 往淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液并水浴加热,无银镜出现 | 该淀粉未发生水解 |
| D | 向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色 | 该溶液中一定含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
14.位于不同短周期的两种主族元素X、Y,已知Y的原子序数为X的2倍,下列说法正确的是( )
| A. | X元素原子的半径一定小于Y元素原子的半径 | |
| B. | Y元素的氧化物不可能与X元素的气态氢化物反应 | |
| C. | X元素与氢元素形成的化合物中一定不含非极性键 | |
| D. | Y元素与X元素原子的最外层电子数一定不相等 |
4.化学与社会生活密切相关,下列说法正确的是( )
| A. | 体积分数为95%的酒精通常作为医用酒精 | |
| B. | 石油的分馏、煤的气化、海水的提镁都包含化学变化 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 利用高纯度硅制造的太阳能电池板可将光能直接转化为电能 |
11.教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图1(KMnO4溶液已熔化)
(1)写出草酸溶于水的电离方程式:H2C2O4?H++HC2O4-,HC2O4-?H++C2O42-.
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是:①<②(填:>、<、=).
(3)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0056mol/L.
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.
(5)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+(或MnSO4)是反应的催化剂②该反应放热.
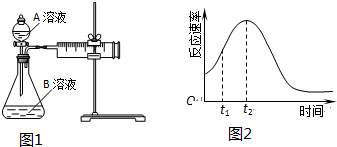
| 实验序号 | 温度T/℃ | A溶液 | B溶液 |
| ① | 30 | 20mL0.1mol•L-1H2C2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
| ② | 20 | 20mL0.1mol•L-1H2S2O4溶液 | 30mL0.01mol•L-1KMnO4溶液 |
(2)该实验探究的是浓度因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是:①<②(填:>、<、=).
(3)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末,c(MnO4-)=0.0056mol/L.
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率.
(5)小组同学发现反应速率总是如图2,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+(或MnSO4)是反应的催化剂②该反应放热.

8.下列物质的电子式书写正确的是( )
| A. |  | B. |  | C. | 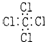 | D. | 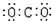 |
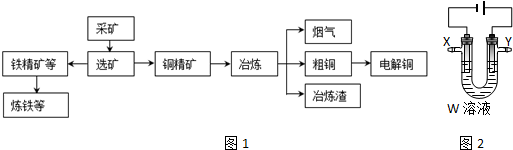
9.某化工厂冶炼金属、回收硫的工艺流程如下:
I.回收硫
(1)工业上,采用饱和亚硫酸钠溶液吸收烟气中二氧化硫,写出离子方程式:SO2+SO32-+H2O=2HSO3-.
然后,加热吸收液收集SO2.将二氧化硫、空气在稀硫酸中构成原电池,负极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ.冶炼铜
(2)工业上,火法冶炼铜分两步:第一步,含铜矿(主要成分是Cu2S)在空气中煅烧生成氧化亚铜和刺激性气味气体;第二步,氧化亚铜和铜矿在高温下反应生成铜和刺激性气体.写出冶炼铜的总反应方程式:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)用电解法精炼粗铜(含银、金、铁、锌杂质),装置如图所示.
下列说法不正确的是BC.
A.Y极为粗铜、X极为纯铜
B.X极净增质量等于Y极净减质量
C.铜盐溶液都可以作精炼铜的电解质溶液
D.若电路有1mol电子转移,则X极净增32g
(4)几种金属离子的沉淀pH:
铜盐溶液中Fe2+,Zn2+对精炼铜可能会产生影响.工业上,除去Fe2+方法是氧化沉淀法,在酸性混合溶液中加入双氧水(选填:双氧水、次氯酸钠、氯水或高锰酸钾溶液)将Fe2+氧化成Fe3+,离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.加入碱调节溶液pH范围为3.7<pH<4.6.
Ⅲ.冶炼铁
(5)化工厂利用菱铁矿(主要成分是碳酸亚铁)冶炼铁的原理是(用化学方程式表示):FeCO3$\frac{\underline{\;高温\;}}{\;}$FeO+CO2↑,FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2.生铁炼钢的主要原理是高温下,用氧化剂降低生铁中碳等杂质含量.
(6)生铁在湿润空气中发生电化学腐蚀最终生成红色铁锈,金属电化腐蚀类型为吸氧腐蚀.

I.回收硫
(1)工业上,采用饱和亚硫酸钠溶液吸收烟气中二氧化硫,写出离子方程式:SO2+SO32-+H2O=2HSO3-.
然后,加热吸收液收集SO2.将二氧化硫、空气在稀硫酸中构成原电池,负极反应式为SO2+2H2O-2e-=SO42-+4H+.
Ⅱ.冶炼铜
(2)工业上,火法冶炼铜分两步:第一步,含铜矿(主要成分是Cu2S)在空气中煅烧生成氧化亚铜和刺激性气味气体;第二步,氧化亚铜和铜矿在高温下反应生成铜和刺激性气体.写出冶炼铜的总反应方程式:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2.
(3)用电解法精炼粗铜(含银、金、铁、锌杂质),装置如图所示.
下列说法不正确的是BC.
A.Y极为粗铜、X极为纯铜
B.X极净增质量等于Y极净减质量
C.铜盐溶液都可以作精炼铜的电解质溶液
D.若电路有1mol电子转移,则X极净增32g
(4)几种金属离子的沉淀pH:
| 金属氢氧化物 | 开始沉淀pH | 完全沉淀的pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.7 |
| Cu(OH)2 | 4.6 | 6.4 |
| Zn(OH)2 | 5.9 | 8.9 |
Ⅲ.冶炼铁
(5)化工厂利用菱铁矿(主要成分是碳酸亚铁)冶炼铁的原理是(用化学方程式表示):FeCO3$\frac{\underline{\;高温\;}}{\;}$FeO+CO2↑,FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2.生铁炼钢的主要原理是高温下,用氧化剂降低生铁中碳等杂质含量.
(6)生铁在湿润空气中发生电化学腐蚀最终生成红色铁锈,金属电化腐蚀类型为吸氧腐蚀.