题目内容
10.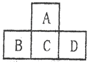 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在周期表中的位置如图所示.E元素的最高价氧化物既能与强酸反应又能与强碱反应.请回答:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在周期表中的位置如图所示.E元素的最高价氧化物既能与强酸反应又能与强碱反应.请回答:(1)写出下列元素的元素符号:AO、BP、DCl.
(2)A元素与氢元素形成的H2A化合物分子中,所含化学键为极性键(填“离子”或“极性”或“非极性”),用电子式表示H2A的形成过程
 ,.
,.(3)A元素与E元素形成的化合物的化学式是Al2O3,该化合物在物质分类中属于两性氧化物氧化物.(填“酸性”,“碱性”或“两性”)
(4)向D元素与E元素形成的化合物的水溶液中滴加NaOH溶液,开始时,实验现象是有白色沉淀出现,反应的离子方程式为Al3++3OH-=Al(OH)3↓;继续滴加NaOH溶液至过量,实验现象是白色沉淀溶解.
分析 A、B、C、D、E五种短周期元素,由位置图可知,A在第二周期,B、C、D处于第三周期,设C的质子数为x,则A的质子数为x-8,B的质子数为x-1,D的质子数为x+1,A、B、C、D四种元素原子核外共有56个电子,则x+(x-8)+(x-1)+(x+1)=56,解得x=16,即A为O,B为P,C为S,D为Cl,E元素的最高价氧化物既能与强酸反应又能与强碱反应,则E为Al,据此答题.
解答 解:A、B、C、D、E五种短周期元素,由位置图可知,A在第二周期,B、C、D处于第三周期,设C的质子数为x,则A的质子数为x-8,B的质子数为x-1,D的质子数为x+1,A、B、C、D四种元素原子核外共有56个电子,则x+(x-8)+(x-1)+(x+1)=56,解得x=16,即A为O,B为P,C为S,D为Cl,E元素的最高价氧化物既能与强酸反应又能与强碱反应,则E为Al,
(1)根据上面的分析可知,A为O,B为P,D为Cl,
故答案为:O;P;Cl;
(2)A元素与氢元素形成的H2A化合物为水,所含化学键为极性键,用电子式表示H2O的形成过程为 ,
,
故答案为: ;
;
(3)A元素与E元素形成的化合物的化学式是Al2O3,Al2O3属于两性氧化物,
故答案为:Al2O3;两性氧化物;
(4)向氯化铝的水溶液中滴加NaOH溶液,开始时,有氢氧化铝沉淀产生,所以实验现象是有白色沉淀出现,反应的离子方程式为 Al3++3OH-=Al(OH)3↓,继续滴加NaOH溶液至过量,氢氧化铝溶解到氢氧化钠中生成偏铝酸钠,实验现象是白色沉淀溶解,
故答案为:有白色沉淀出现;Al3++3OH-=Al(OH)3↓;白色沉淀溶解.
点评 本题考查元素周期表和元素周期律,元素的推断是解答本题的关键,注意理解同主族元素质子数关系,注意利用电子守恒确定元素化合价,难度不大.

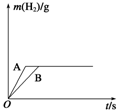 将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )
将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )| A. | 投入的Na、K的质量一定相等 | |
| B. | 投入的Na的质量小于K的质量 | |
| C. | 曲线A表示Na与盐酸反应,曲线B表示K与盐酸反应 | |
| D. | 该实验能证明K的金属性小于Na的金属性 |
| A. | 16 | B. | 26 | C. | 36 | D. | 46 |
| A. | D(2H)和T(3H) | B. | 40K和40Ca | C. | O2和O3 | D. | Na和Na+ |
| A. | 6:1 | B. | 5:1 | C. | 7:1 | D. | 4:1 |
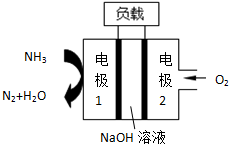
| A. | 电池工作时,Na+向负极移动 | |
| B. | 通氨气的电极1作电池的正极 | |
| C. | 电子由电极2经外电路流向电极1 | |
| D. | 燃料电池的总反应为:4NH3+3O2=2N2+6H2O |
| A. | 加热Al2O3 | B. | 加热HgO | C. | 电解熔融NaCl | D. | 铝粉和Fe2O3共热 |
| A. | 仅用酸性高锰酸钾溶液可区分苯和甲苯 | |
| B. | 仅用氯化铁溶液可区分苯酚稀溶液和甘油 | |
| C. | 仅用硝酸银溶液可验证卤代烃中卤原子的种类 | |
| D. | 仅用溴的四氯化碳溶液可区别液态的植物油和动物油 |