题目内容
9.在下列各溶液中,离子一定能大量共存的是( )| A. | 能使紫色石蕊试液变红的溶液中:Fe2+、Na+、SO42-、NO3- | |
| B. | 碱性溶液中:Na+、K+、NO3-、ClO- | |
| C. | pH=1的溶液中:Na+、Cu2+、Cl-、S2- | |
| D. | 加入Al能放出氢气的溶液中:NH4+、SO42-、NO3-、ClO- |
分析 A.能使紫色石蕊试液变红的溶液中中存在大量的氢离子,硝酸根离子在酸性条件下能够氧化亚铁离子;
B.碱性溶液中存在大量OH-,四种离子之间不发生反应,都不与氢氧根离子反应;
C.pH=1的溶液为酸性溶液中,溶液中存在大量氢离子,铜离子与硫离子反应生成硫化铜沉淀,硫离子与氢离子反应生成硫化氢;
D.加入铝放出氢气的溶液中存在大量氢离子或氢氧根离子,铵根离子与氢氧根离子反应,次氯酸根离子能够结合氢离子,硝酸根离子在酸性条件下具有强氧化性,加入铝不会放出氢气.
解答 解:A.能使紫色石蕊试液变红的溶液为酸性溶液,NO3-在酸性条件下能够氧化Fe2+,在溶液中不能大量共存,故A错误;
B.Na+、K+、NO3-、ClO-之间不反应,都不与碱性溶液中的OH-反应,在溶液中能够大量共存,故B正确;
C.Cu2+、S2-之间反应生成硫化铜沉淀,S2-还能够与pH=1的溶液中的H+反应,在溶液中一定不能大量共存,故C错误;
D.该溶液为酸性或强碱性溶液,NH4+能够与强碱溶液中的OH-反应,ClO-能够与H+反应生成HClO,NO3-在酸性条件下具有强氧化性,加入铝后不会生成氢气,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
19.江苏省已开始大力实施“清水蓝天”工程.下列不利于“清水蓝天”工程实施的是( )
| A. | 将废旧电池深埋,防止污染环境 | |
| B. | 加强城市生活污水脱氮除磷处理,遏制水体富营养化 | |
| C. | 积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用 | |
| D. | 大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染 |
1. 将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )
将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )
 将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )
将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )| A. | 投入的Na、K的质量一定相等 | |
| B. | 投入的Na的质量小于K的质量 | |
| C. | 曲线A表示Na与盐酸反应,曲线B表示K与盐酸反应 | |
| D. | 该实验能证明K的金属性小于Na的金属性 |
18.第ⅠA族的两种元素的原子序数之差不可能是( )
| A. | 16 | B. | 26 | C. | 36 | D. | 46 |
19.下列冶炼方法中,不能将化合物中的金属元素还原为金属单质的是( )
| A. | 加热Al2O3 | B. | 加热HgO | C. | 电解熔融NaCl | D. | 铝粉和Fe2O3共热 |
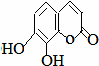 瑞香是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示,回答下列问题.
瑞香是一种具有抗菌、抗炎、抗凝血等生物活性的香豆素化合物,其分子结构如图所示,回答下列问题.