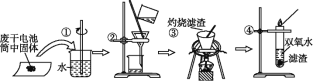
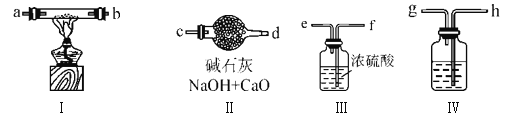
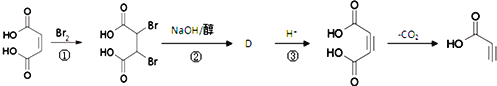
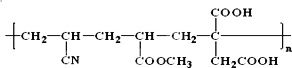题目内容
【题目】下表为元素周期表的一部分,请参照元素①——⑨在表中的位置,回答问题
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中⑧是用于半导体材料的元素,其元素符号为____,其在周期表中的位置是____。
(2)②、③、④的原子半径最小是____(填元素符号),其原子结构示意图是____。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是____(填化学式)。
(4)①和③形成的原子个数比为1:1的化合物的电子式为____。
(5)⑤和⑨形成的化合物属于____(填“离子化合物”或“共价化合物”),用电子式表示其形成过程____
【答案】Si 第三周期第IVA族 F  NaOH
NaOH ![]() 离子化合物
离子化合物 ![]()
【解析】
根据元素周期表的结构和元素周期律的变化规律以及电子式的书写方法进行分析解答。
(1)表中⑧号元素位于周期表中第三周期第IVA族,该元素是用于半导体材料的Si元素;
(2)同周期自左向右原子半径逐渐减小,则②、③、④中④的原子半径最小,④号元素位于周期表中第二周期VIIA族,为F元素,其原子结构示意图是 ;
;
(3)⑤、⑥、⑦分别为Na、Mg、Al,同周期自左向右金属性逐渐减弱,而金属性越强,其最高价氧化物对应的水化物的碱性越强,则碱性最强的是NaOH;
(4)①为H元素,③为O元素,二者形成的原子个数比为1:1的化合物为H2O2,其为共价化合物,电子式为![]() ;
;
(5)⑤为Na,⑨为Cl,二者形成离子化合物,用电子式表示其形成过程为![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】某学习小组同学根据影响化学反应速率的因素进行实验验证,其设计的实验方案如下:请你帮他们把表填写完整,并做出评价。
(1)甲同学验证还原性:I->Br-
实验步骤 | 实验现象 | 实验结论及离子反应式 |
| 逐滴加入的同时振荡,观察CCl4层的颜色: 甲___ 乙___; 乙中CCl4层颜色明显变化的快。 | 离子方程式: 甲__ 乙__ 结论:验证成立,还原性,I->Br- |
(评价)甲同学设计的实验方案是__(填“合理”或“不合理”),理由是__。
(3)乙同学验证固体反应物的颗粒大小的对反应速率影响
实验步骤:在试管①中加入1g粉末状大理石,加入4mol/L盐酸20mL(过量);在试管②中加入2g颗粒状大理石,加入4mol/L盐酸20mL(过量)。他根据实验过程,绘制出的生成CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图,你认为__是符合的。