题目内容
【题目】在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应,2NO2(g)(红棕色)![]() N2O4(g)(无色),如图所示。
N2O4(g)(无色),如图所示。

(1)曲线____(填“X”或“Y”)表示NO2的物质的量随时间的变化曲线,
(2)若降低温度,则v(正)____,v(逆)____.(填“加快"或“减慢"或“不变”)
(3)在0到3min中内X的反应速率为____
(4)达到反应限度时X的转化率为____,注:物质的转化率= ![]() ×100%
×100%
【答案】X 减慢 减慢 0.1mol/(L·min) 60%
【解析】
由图可知3min时达平衡,X减少0.6mol,Y增加0.3mol。
(1)由图可知平衡时X减少0.6mol,Y增加0.3mol,物质的量比为2:1,根据反应2NO2(g)(红棕色)![]() N2O4(g)(无色)的化学计量数,则曲线X表示NO2的变化曲线;
N2O4(g)(无色)的化学计量数,则曲线X表示NO2的变化曲线;
(2)降低温度,减慢反应速率,则v(正) 减慢,v(逆) 减慢;
(3) 0到3min中,X减少0.6mol, X的反应速率为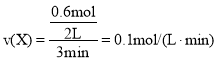 ;
;
(4)达到反应限度时X的转化率为![]() 。
。

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
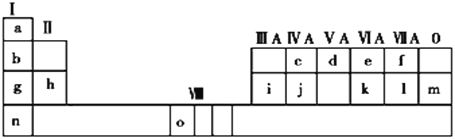
【题目】下表为元素周期表的一部分,请参照元素①——⑨在表中的位置,回答问题
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中⑧是用于半导体材料的元素,其元素符号为____,其在周期表中的位置是____。
(2)②、③、④的原子半径最小是____(填元素符号),其原子结构示意图是____。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物,碱性最强的是____(填化学式)。
(4)①和③形成的原子个数比为1:1的化合物的电子式为____。
(5)⑤和⑨形成的化合物属于____(填“离子化合物”或“共价化合物”),用电子式表示其形成过程____