题目内容
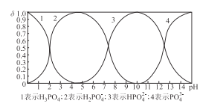
【题目】下列事实不能用勒夏特列原理解释的是
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.反应2HI(g)![]() H2(g)+I2(g) 达平衡后,缩小反应容器体积,混合气体颜色变深
H2(g)+I2(g) 达平衡后,缩小反应容器体积,混合气体颜色变深
C.合成氨工厂通常采用20 MPa~50 MPa压强,以提高原料的利用率
D.用HCl溶液代替蒸馏水洗涤AgCl,可以减少沉淀损失
【答案】B
【解析】
勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动;使用勒夏特列原理时,该反应必须是可逆反应,且平衡需发生移动。
A.工业生产硫酸的过程中使用过量的氧气,有利用平衡向正反应方向移动,可用勒夏特列原理解释,故A不选;
B. 反应2HI(g)![]() H2(g)+I2(g) 达平衡后,缩小反应容器体积,由于反应为等体积反应,平衡不移动,由于体积减小浓度增大混合气体颜色变深,不能用勒夏特列原理解释,故B正确;
H2(g)+I2(g) 达平衡后,缩小反应容器体积,由于反应为等体积反应,平衡不移动,由于体积减小浓度增大混合气体颜色变深,不能用勒夏特列原理解释,故B正确;
C. 合成氨工厂通常采用高压(20MPa50Mpa)条件,有利用平衡向正反应方向移动,可用勒夏特列原理解释,故C不选;
D.![]() ,用盐酸洗增大Cl-浓度,使平衡逆移,可以减少沉淀损失,可以用勒夏特列原理解释,故D正确;
,用盐酸洗增大Cl-浓度,使平衡逆移,可以减少沉淀损失,可以用勒夏特列原理解释,故D正确;
故答案选:B。

 阅读快车系列答案
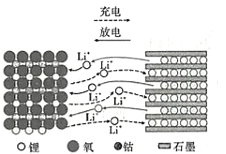
阅读快车系列答案【题目】如图所示,某化学兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:

(1)通入氧气的电极为_____(填“正极”或“负极”),此电极反应式为_________。
(2)铁电极为_______(填“阳极”或“阴极”),乙装置中电解反应的化学方程式为_________________。
(3)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:
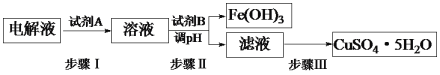
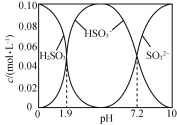
已知:几种金属阳离子开始沉淀和沉淀完全的pH。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ | 1.9 | 3.2 |
Fe2+ | 7.6 | 9.6 |
Cu2+ | 4.7 | 6.7 |
①步骤I中加入试剂A的目的是_____________________________,试剂A应选择______(填序号);
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
②步骤II中试剂B为_________(答出一种即可),调节pH的范围是___________;
③步骤III的操作是加热浓缩、___________、过滤。