��Ŀ����
����Ŀ�������仯����㷺���������ǵ��ճ������ҵ�����С��ش��������⣺
(1)��̬Feԭ�ӵĺ�������Ų�ʽ��________��CaԪ����FeԪ��ͬ���ڣ�����![]() ������Ϊש��ɫ��������ȼ�ŵ�����䷽�г�����CaԪ�أ�����CaԪ�س���������ɫ��ԭ����____
������Ϊש��ɫ��������ȼ�ŵ�����䷽�г�����CaԪ�أ�����CaԪ�س���������ɫ��ԭ����____
(2)������Ѫ�쵰�Ľṹ��ʽ��ͼ��ʾ��
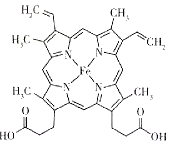
�����Ѫ�쵰��5��Ԫ���У��縺���ɴ�С��˳����_________��C��N��O�ĵ�һ�������ɴ�С��˳����_______��
��Ѫ�쵰���ӽṹ��N���ӻ���ʽ��_______��
��Ѫ�쵰���ӽṹ�к�����λ����Ϊ��Щ��λ���ṩ�µ��ӶԵ�Ԫ����_______(дԪ�ط��ţ���ͬ)���ṩ�չ����Ԫ����______��
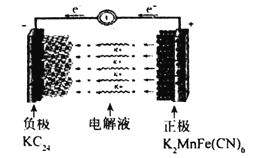
(3)![]() ��Ӧ���ڹ�ҵ�����еĴ������侧���ṹ��ͼ��ʾ��
��Ӧ���ڹ�ҵ�����еĴ������侧���ṹ��ͼ��ʾ��
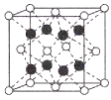
����֪�縺�ԣ�Fe-1.83��Br-2.96����![]() �к��еĻ�ѧ������Ϊ_________��
�к��еĻ�ѧ������Ϊ_________��
��![]() ���������������_________��
������������λ����_________��![]() �����߳�Ϊa cm����
�����߳�Ϊa cm����![]() �����ܶȵı���ʽΪ_____________
�����ܶȵı���ʽΪ_____________![]() (�谢���ӵ�������ֵΪNA)��
(�谢���ӵ�������ֵΪNA)��
���𰸡�![]() ����̬�ĵ���ԾǨ����̬ʱ�ͷų����� O>N>C>H>Fe N>O>C
����̬�ĵ���ԾǨ����̬ʱ�ͷų����� O>N>C>H>Fe N>O>C ![]() N Fe ���ۼ� 8
N Fe ���ۼ� 8 ![]()
��������
(1)Feԭ��Ϊ26��Ԫ�أ����������Ų�ʽΪ![]() (��
(��![]() )�����ӴӼ���̬ԾǨ����̬ʱ�ͷų��������Թ����ʽ�ͷš�
)�����ӴӼ���̬ԾǨ����̬ʱ�ͷų��������Թ����ʽ�ͷš�
(2)��һ������£�����Ԫ�صĵ縺�Աȷǽ���Ԫ�ص�����ͬ���ڴ����ң��縺������ǿ���ʵ縺�ԣ�O>N>C>H>Fe��N�ĺ�������Ų�ʽΪ![]() ������p�����3�����ӣ����ڰ����״̬�����ȶ�����N�ĵ�һ�����ܴ���O�����Ե縺�ԣ�N>O>C��
������p�����3�����ӣ����ڰ����״̬�����ȶ�����N�ĵ�һ�����ܴ���O�����Ե縺�ԣ�N>O>C��
��̼��˫���е�NΪ![]() �ӻ�������������Ϊ������NΪ
�ӻ�������������Ϊ������NΪ![]() �ӻ���
�ӻ���
����Ѫ�쵰�Ľṹ��ʽ��֪N��Fe�γ�2����λ����N�ṩ�¶Ե��ӣ�Fe�ṩ�չ����
(3)��Fe��Br�縺��֮��С��1.7����Ϊ���ۼ���
����![]() �����ṹ��֪����Fe�Ⱦ����������Br��8������
�����ṹ��֪����Fe�Ⱦ����������Br��8������![]() ������֪��1�������к�8��Br������4��Fe����1������������
������֪��1�������к�8��Br������4��Fe����1������������![]() �������V=a3 cm3�������ܶ�Ϊ
�������V=a3 cm3�������ܶ�Ϊ![]() ��
��