题目内容
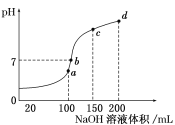
【题目】已知常温下H2A的K1=1.0×10-4,K2=5.0×10-7。向20mLlmol·L-1的H2A溶液中逐滴滴入2mol·L-1的NaOH溶液,溶液中水电离出的c水(OH-)随加入NaOH溶液的体积V的变化如图所示,下列分析正确的是( )
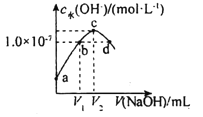
A.V1<10,V2=20
B.a点溶液的pH=3
C.c点溶液c水(H+)≈1.0×10-4mol·L-1
D.b、d点溶液均呈中性
【答案】C
【解析】
A.若加入NaOH溶液的体积为10mL,NaOH与H2A反应恰好生成NaHA,HA-可以电离也可以水解。HA-的电离平衡常数K2=5.0×10-7,HA-的水解平衡常数![]() ,HA-的电离能力大于水解,则NaHA溶液显酸性,会抑制水的电离,则水电离c(OH-)<10-7mol·L-1。根据图示,b点水电离出来的c(OH-)=10-7mol·L-1,则加入的NaOH应大于10mL,则V1>10mL。c点水电离出来的c(OH-)最大,则溶液中只有盐,溶质只有Na2A,V2=20mL。A错误;
,HA-的电离能力大于水解,则NaHA溶液显酸性,会抑制水的电离,则水电离c(OH-)<10-7mol·L-1。根据图示,b点水电离出来的c(OH-)=10-7mol·L-1,则加入的NaOH应大于10mL,则V1>10mL。c点水电离出来的c(OH-)最大,则溶液中只有盐,溶质只有Na2A,V2=20mL。A错误;
B.a点为1mol·L-1的H2A,该二元酸电离程度较小,则c(H+)≈c(HA-),c(H2A)≈1mol·L-1,![]() ,可求得c(H+)≈0.01mol·L-1,pH=2,B错误;
,可求得c(H+)≈0.01mol·L-1,pH=2,B错误;
C.c点酸碱恰好完全反应生成正盐,则溶液中溶质为Na2A,A2-水解,A2-+H2O![]() HA-+OH-,溶液中c(OH-)≈c(HA-),水解较为微弱,则c(A2-)≈0.5mol/L,A2-的水解平衡常数
HA-+OH-,溶液中c(OH-)≈c(HA-),水解较为微弱,则c(A2-)≈0.5mol/L,A2-的水解平衡常数![]() ,又
,又![]() ,可得
,可得![]() ,带入数据,可求得c(OH-)≈10-4mol·L-1,溶液中的OH-均来自会水的电离,水电离出来的OH-和水电离出来的H+相等,则c点溶液水电离出来的c水(H+)≈10-4mol·L-1,C正确;
,带入数据,可求得c(OH-)≈10-4mol·L-1,溶液中的OH-均来自会水的电离,水电离出来的OH-和水电离出来的H+相等,则c点溶液水电离出来的c水(H+)≈10-4mol·L-1,C正确;
D.a点溶液为酸性,c点溶液为碱性,溶液从酸性转化到碱性过程中会有某处溶液为中性,其水电离出的c(OH-) =10-7mol·L-1,则b点溶液为中性。d点溶液为在c点溶液的基础上再加入NaOH溶液,则d点溶液为碱性,D错误。
答案选C。

 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案