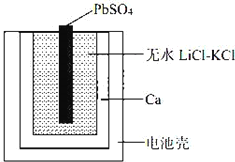
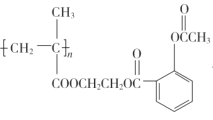
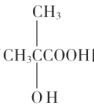
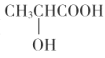题目内容
【题目】镁电池因具有高的安全性和低廉的价格而备受关注,我国科学 家最近研发出一种新型镁电池,其工作原理如图所示。下列说法正确的是

A.I 室中的电解质溶液可以是稀 H2SO4
B.外电路中转移 2mol 电子时,N 极质量增加 24a g
C.离子交换膜为阳离子交换膜
D.电子流向:M 电极→I 室→离子交换膜→II 室→N 极
【答案】C
【解析】
A. 根据图中信息得出Mg为负极,镁与稀硫酸反应,所以I室中的电解质溶液不可以是稀 H2SO4,故A错误;
B. 电池工作时,镁在负极失去电子变为镁离子进入I室,同时II室中的镁离子嵌入正极材料,N极的电极反应式为MgxNiyCo2O2 + aMg2+ + 2ae- = Mgx+aNiyCo2O2,外电路中转移2mol电子时,N极质量增加24g,故B错误;
C. I室中镁离子进入到II室中,因此离子交换膜为阳离子交换膜,故C正确;
D. 电子流向:M电极→导线→N极,故D错误。
综上所述,答案为C。

【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下:2CH4(g)C2H4(g)+2H2(g) ΔH>0
化学键 | H—H | C—H | C=C | C—C |
E(kJ/mol) | a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=____________ (用含a、b、c、d的代数式表示)。
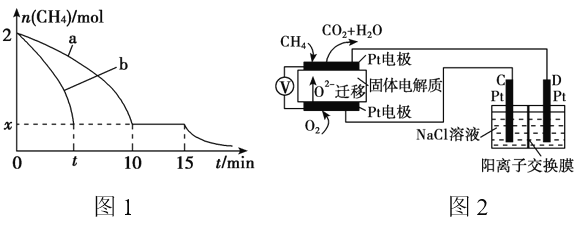
(2)T1温度时,向1 L的恒容反应器中充入2mol CH4 ,仅发生上述反应,反应过程中 0~15min CH4的物质的量随时间变化如图1,测得10~15min时H2的浓度为1.6mol/L。
①0~10min内CH4表示的反应速率为__________mol/(L·min)。
②若图1中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(CH4)变化曲线,其中表示催化剂表面积较大的曲线是 ________ (填“a”或 “b”)。
③15min时,若改变外界反应条件,导致n(CH4)发生图1中所示变化,则改变的条件可能是_____________________________________(任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2)其中k正、k逆为速率常数仅与温度有关,T1温度时k正与k逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数v正____v逆(填“>”“=”或“<”),判断的理由是_________________ 。
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-。
①C极的Pt为______ 极(填“阳”或“阴” )。
②该电池工作时负极反应方程式为_____________________。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112mL,则阴极区所得溶液在25℃时pH=_______ (假设电解前后NaCl溶液的体积均为500mL)。