题目内容
【题目】磷的含氧酸有磷酸(H3PO4)、亚磷酸(H3PO3)、次磷酸(H3PO2)等多种,它们在工业上都是重要的化工原料。
(1)亚磷酸(H3PO3)是一种二元弱酸,写出H3PO3与过量NaOH溶液反应的化学方程式:_______。某温度下,0.01 mol L-1 H3PO3溶液的pH为2.7,该温度下,H3PO3 的一级电离常数 Kal=_______。 (已知:lg2 = 0.3,lg3 = 0.5,lg5 = 0.7,H3PO3 的第二步电离忽略不计)
(2)某实验小组用NaOH溶液处理含H3PO3废水,当溶液中c (Na+) =c(H2PO3-) + 2c(HPO32-)时,溶液呈______性(填“酸”“碱”或“中”)。
(3)已知:常温下,磷酸(H3PO4)的 Kal=7.ll×10-3、Ka2 = 6.23×10-8、Ka3 = 4.5 ×10-13, 则常温下,Na2HPO4溶液中H2PO4-、HPO42-和PO43-的浓度由大到小的顺序为________。
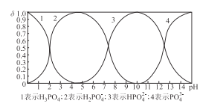
(4)向某浓度的磷酸溶液中滴加NaOH溶液,其pH与溶液中H3PO4、H2PO4-、HPO42-和PO43-的物质的量分数为δ (平衡时某物种的浓度与整个物种浓度之和的比值)的关系如图所示。以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是_________。
(5)已知:常温下,Ksp(FePO4) = l.3×10-22、Ksp(A1PO4) = 5.2 ×10-19。常温下,向含Fe3+、A13+的混合溶液中滴加Na3PO4溶液,当FePO4、AlPO4同时生成时,溶液中c(Fe3+):c(Al3+ ) =_________。
【答案】H3PO3 + 2NaOH = Na2HPO3 + 2H2O 4.0×10-4 中 c(HPO42-)>c(H2PO4-)>c(PO43-) H2PO4- + OH- = HPO42- + H2O 2.5×10-4
【解析】
(1)亚磷酸(H3PO3)是一种二元弱酸,1mol H3PO3需要2molNaOH恰好完全反应,故H3PO3与过量NaOH溶液反应的化学方程式为H3PO3 + 2NaOH = Na2HPO3 + 2H2O;某温度下,0.01 mol L-1 H3PO3溶液的pH为2.7,则c(H+)=10-2.7mol/L,由于H3PO3 的第二步电离忽略不计,c(H2PO3-)≈c(H+)=10-2.7mol/L,H3PO3的一级电离常数 Kal=![]() =4.0×10-4;
=4.0×10-4;
(2)用NaOH溶液处理含H3PO3废水所的溶液中存在电荷守恒:c (Na+) + c (H+) = c (OH-)+ c(H2PO3-) + 2c(HPO32-),结合c (Na+) =c(H2PO3-) + 2c(HPO32-),因而c (H+) = c (OH-),溶液呈中性;
(3) Na2HPO4溶液中,HPO42-水解方程式:HPO42-+ H2O H2PO4-+ OH-,Kh(HPO42-)=![]() =1.6×10-7,HPO42-电离方程式:HPO42-= PO43-+ H+,Ka3 = 4.5 ×10-13< Kh(HPO42-) =1.6×10-7,说明HPO42-水解程度大于其电离程度,因而c(H2PO4-)>c(PO43-),又水解或电离是微弱的,HPO42-的浓度最大,所以c(HPO42-)>c(H2PO4-)>c(PO43-);
=1.6×10-7,HPO42-电离方程式:HPO42-= PO43-+ H+,Ka3 = 4.5 ×10-13< Kh(HPO42-) =1.6×10-7,说明HPO42-水解程度大于其电离程度,因而c(H2PO4-)>c(PO43-),又水解或电离是微弱的,HPO42-的浓度最大,所以c(HPO42-)>c(H2PO4-)>c(PO43-);
(4)酚酞的变色范围是 8.2~10.0,结合图象知此时H2PO4-物质的量分数为δ减少,HPO42-的物质的量分数为δ增加,因而以酚酞为指示剂,当溶液由无色变为浅红色时,发生主要反应的离子方程式是H2PO4- + OH- = HPO42- + H2O;
(5)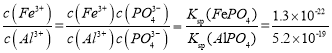 = 2.5×10-4,故溶液中c(Fe3+):c(Al3+ ) =2.5×10-4。
= 2.5×10-4,故溶液中c(Fe3+):c(Al3+ ) =2.5×10-4。

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】中国的稀土资源十分丰富,有开采价值的储量居世界第一。某实验小组拟利用含铝、硅、铁等杂质的氟碳钵矿(主要成分为CeFCO3)制备三氯化铈,设计如图所示流程:
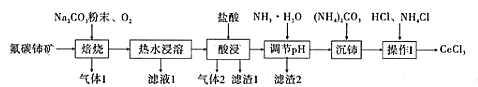
已知:①Ce2O3在加热条件下能被氧气氧化,生成难溶于水、具有强氧化性的CeO2。
②M(CeCl3)=246.5g/mol,在水溶液中Ce4+能被还原成Ce3+。
③0.1mol·L-1金属阳离子形成氢氧化物沉淀的pH如下:
金属阳离子 | Fe3+ | Ce3+ | Al3+ |
开始沉淀的pH | 1.5 | 7.6 | 3.4 |
沉淀完全的pH | 2.8 | 9.4 | 4.7 |
回答下列问题:
(1)氟碳铈矿中铈的化合价为______,滤渣1的化学式为__________。
(2)焙烧氟碳铈矿生成CeO3的化学方程式是____________。
(3)酸浸时产生气体2的离子反应方程式是_______。
(4)为将铝、铁以滤渣2除去,用NH3·H2O调节酸浸后溶液的pH最大不能超过______。
(5)将沉铈得到的Ce2(CO3)3·nH2O洗涤干净后继续进行操作I,简述如何证明Ce2(CO3)3·nH2O已经洗涤干净________。
(6)操作I是将得到的Ce2(CO3)3·nH2O加盐酸至沉淀完全溶解,先经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到CeCl3·7H2O,再将该晶体与NH4Cl固体隔绝空气共热,得到无水CeCl3。其中,NH4Cl的作用是___________。
(7)产品纯度测定:准确称取CeCl3产品0.3750g于锥形瓶中,加入合适的氧化剂将Ce3+恰好完全氧化为Ce4+,再用0.1000mol/L的(NH4)2Fe(SO4)2 标准溶液滴定至终点,重复3次实验,标准液的消耗体积分别为12.48mL、12.50mL、12.52mL。求该样品的质量分数为_______(保留1位小数)。
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下:2CH4(g)C2H4(g)+2H2(g) ΔH>0
化学键 | H—H | C—H | C=C | C—C |
E(kJ/mol) | a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=____________ (用含a、b、c、d的代数式表示)。
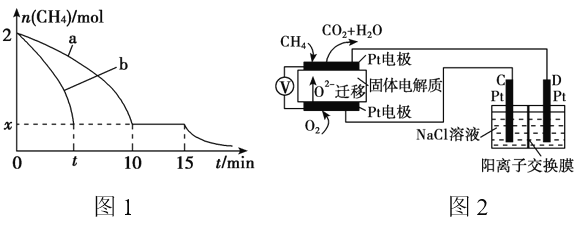
(2)T1温度时,向1 L的恒容反应器中充入2mol CH4 ,仅发生上述反应,反应过程中 0~15min CH4的物质的量随时间变化如图1,测得10~15min时H2的浓度为1.6mol/L。
①0~10min内CH4表示的反应速率为__________mol/(L·min)。
②若图1中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(CH4)变化曲线,其中表示催化剂表面积较大的曲线是 ________ (填“a”或 “b”)。
③15min时,若改变外界反应条件,导致n(CH4)发生图1中所示变化,则改变的条件可能是_____________________________________(任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2)其中k正、k逆为速率常数仅与温度有关,T1温度时k正与k逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数v正____v逆(填“>”“=”或“<”),判断的理由是_________________ 。
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-。
①C极的Pt为______ 极(填“阳”或“阴” )。
②该电池工作时负极反应方程式为_____________________。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112mL,则阴极区所得溶液在25℃时pH=_______ (假设电解前后NaCl溶液的体积均为500mL)。