题目内容
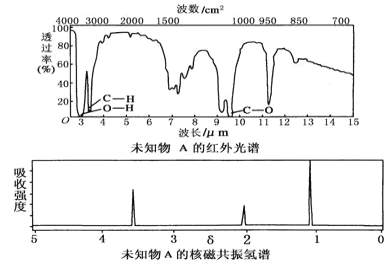
【题目】25 ℃时,将SO2通入NaOH溶液得到一组c(H2SO3)+c(HSO3-)+c(SO32-)=0.100 mol·L-1的混合溶液,溶液中部分微粒的物质的量浓度随pH的关系曲线如右下图所示。下列叙述正确的是
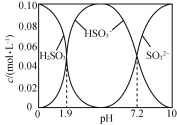
A.H2SO3的Ka2=10-7.2
B.pH=1.9的溶液中:c(Na+)>c(H2SO3)=c(HSO3-)> c(SO32-)
C.c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
D.c(HSO3-)=0.050 mol·L-1的溶液中:c(H+)+c(Na+)<0.150 mol·L-1+c(OH-)
【答案】AD
【解析】
A.当pH=7.2时,c(H+)=10-7.2mol/L,c(SO32-)=c(HSO3-),H2SO3的二级电离方程式为:HSO3-H++SO32-,Ka2=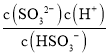 = c(H+)=10-7.2,故A正确;
= c(H+)=10-7.2,故A正确;
B.根据图示,pH=1.9时,溶液中不含SO32-,故B错误;
C.溶液中存在电荷守恒:c(Na+)+ c(H+)= 2c(SO32-)+ c(HSO3-)+ c(OH-),c(Na+)=0.100 mol·L-1时,c(H2SO3)+c(HSO3-)+c(SO32-)=c(Na+),代入电荷守恒式中可得:c(H+)+c(H2SO3)=c(OH-)+c(SO32-),故C错误;
D.根据c(H2SO3)+c(HSO3-)+c(SO32-)=0.100 mol·L-1,溶液中的c(HSO3-)=0.050 mol·L-1,则c(H2SO3)+c(SO32-)=0.05mol·L-1,溶液中存在电荷守恒:c(Na+)+ c(H+)= 2c(SO32-)+ c(HSO3-)+ c(OH-)=2×(0.05mol·L-1- c(H2SO3))+ 0.05mol·L-1+ c(OH-)= 0.150 mol·L-1+c(OH-)-2 c(H2SO3),则c(H+)+c(Na+)<0.150 mol·L-1+c(OH-),故D正确;
答案选AD。

 阅读快车系列答案
阅读快车系列答案