题目内容
20.二元酸H2A在水中的电离情况是:H2A=H++HA-和HA-?H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系错误的是( )| A. | NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+) | B. | NaHA:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) | ||
| C. | Na2A:c(Na+)>c(A2-)>c(OH-)>c(H+) | D. | H2A:c(H+)=c(HA-)+2c(A2-)-c(OH-) |
分析 根据二元酸H2A在水中的电离情况H2A=H++HA-和HA-?H++A2-可知,该二元酸第一步完全电离,第二步部分电离,所以溶液中A2-能水解,HA-只能电离不能水解,
A.HA-只能电离不能水解,所以溶液呈酸性,则c(H+)>c(OH-);
B.根据溶液中的电荷守恒判断;
C.Na2A溶液中A2-能水解,溶液呈碱性,则c(OH-)>c(H+);
D.根据溶液中的电荷守恒分析.
解答 解:该二元酸第一步完全电离,第二步部分电离,所以溶液中A2-能水解,HA-只能电离不能水解,
A.NaHA溶液中:HA-只能电离不能水解,所以溶液呈酸性,则c(H+)>c(OH-),正确的离子浓度大小为:c(Na+)>c(HA-)>c(H+)>c(OH-),故A错误;
B.根据NaHA溶液中的电荷守恒可知:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),故B正确;
C.Na2A溶液中A2-能水解而使溶液中c(OH-)>c(H+),盐溶液中A2-的水解程度较小,所以c(A2-)>c(OH-),钠离子不水解,其浓度最大,所以离子浓度大小顺序是c(Na+)>c(A2-)>c(OH-)>c(H+),故C正确;
D.根据电荷守恒c(H+)=c(HA-)+2 c(A2-)+c(OH-)可得:c(H+)=c(HA-)+2c(A2-)-c(OH-),故D正确;
故选A.
点评 本题考查了离子浓度大小的比较,题目难度中等,明确该二元酸的电离方式是解本题关键,注意第一步是完全电离,第二步是部分电离,导致HA-只能电离不能水解,为易错点.

练习册系列答案
相关题目
10.下列各项中的两个量,其比值一定为2:1的是( )
| A. | 相同温度下,0.2mol•L-1醋酸溶液与0.1mol•L-1醋酸中的c(H+ )之比 | |
| B. | 在Na2O2晶体中阳离子与阴离子的物质的量之比 | |
| C. | 液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液的体积之比 | |
| D. | 22.4LCO2与22.4L CO所含氧原子数目之比 |
8.下列化学用语表达正确的是( )
| A. | 环已烷的结构简式 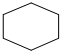 | B. | C2H4的球棍模型 | ||
| C. | 四氯化碳的电子式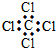 | D. | 苯的分子式 |
5.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$\frac{\underline{\;\;\;\;\;催化剂\;\;\;\;\;}}{500℃30MPa}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3 |
12.乙酸和乙烯的混合物,若其中氧的质量分数为a,则碳的质量分数是( )
| A. | $\frac{1}{7}$(1-a) | B. | $\frac{3}{4}$a | C. | $\frac{6}{7}$ (1-a) | D. | $\frac{12}{13}$ (1-a) |
9.有关化学用语正确的是( )
| A. | 乙烯的实验式C2H4 | B. | 乙醇的结构简式C2H6O | ||
| C. | 四氯化碳的电子式: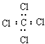 | D. | 3,3,4-三甲基已烷的分子式C9H20 |
10.如图是常见四种有机物的比例模型示意图.下列说法正确的是( )
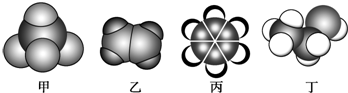

| A. | 甲能使酸性高锰酸钾溶液褪色 | |
| B. | 乙可与溴水发生加成反应使溴水褪色 | |
| C. | 丙与溴水可以发生取代反应 | |
| D. | 丁在稀硫酸作用下可与乙酸发生取代反应 |