题目内容
11.12.0g某液态有机化合物A完全燃烧后,生成14.4gH2O和26.4g CO2.测得有机化合物A的蒸气与H2的相对密度是30,求:(1)通过计算确定有机物A的分子式.
(2)若该物质能与金属钠反应放出气体,请你写出A可能的结构简式.
分析 (1)由n=$\frac{m}{M}=\frac{V}{{V}_{m}}$可知,$ρ=\frac{m}{V}=\frac{M}{{V}_{m}}$,在相同条件下气体的相对分子质量之比等于密度之比,该化合物的蒸气对氢气的相对密度为30,则该化合物的相对分子质量为30×2=60,根据有机物的质量计算出有机物的物质的量,根据生成水和二氧化碳的物质的量结合质量守恒可计算出该有机物的分子式为C3H8O,
(2)该物质能与金属钠反应放出气体,应含有羟基,以此确定结构简式.
解答 解:(1)由n=$\frac{m}{M}=\frac{V}{{V}_{m}}$可知,$ρ=\frac{m}{V}=\frac{M}{{V}_{m}}$,在相同条件下气体的相对分子质量之比等于密度之比,该化合物的蒸气对氢气的相对密度为30,
则该化合物的相对分子质量为30×2=60,
则:n(有机化合物)=$\frac{12.0g}{60g/mol}$=0.2mol,
n(H2O)=$\frac{14.4g}{18g/mol}$=0.8mol,
n(CO2)=$\frac{26.4g}{44g/mol}$=0.6mol,
12.0g有机物中含有:m(C)=0.6mol×12g/mol=7.2g,
m(H)=2×0.8mol×1g/mol=1.6g,
则m(O)=12.0g-7.2g-1.6g=3.2g,
n(O)=$\frac{3.2g}{16g/mol}$=0.2mol,
所以有机物中含有:N(C)=$\frac{0.6mol}{0.2mol}$=3,N(H)=$\frac{1.6mol}{0.2mol}$=8,N(O)=$\frac{0.2mol}{0.2mol}$=1,
则有机物分子式为C3H8O,
答:有机物A的分子式为C3H8O;
(2)由A可与金属钠反应放出气体,可知A为醇类,则A的结构简式可能为:CH3CH2CH2OH或CH3CH(OH)CH3,
答:A可能的结构简式为CH3CH2CH2OH或CH3CH(OH)CH3.
点评 本题考查了有机物分子式的确定,题目难度中等,明确相对密度与摩尔质量的关系为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案| 元素 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的金属阳离子中半径最小 |
| W | 单质制成的高压灯,发出的黄光透雾力强、射程远.且其单质燃烧后生成淡黄色固体 |

(2)元素W的单质燃烧后生成淡黄色固体的化学方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2
(3)元素Y与氢元素形成一种离子YH4+,则检测溶液中存在该离子的方法是取溶液少许,向溶液中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+
(4)Z元素最高价氧化物对应的水化物与W元素最高价氧化物对应的水化物的溶液反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(5)元素X与元素Y相比.非金属性较强的是N(填元素符号),下列表述中证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同:
b.Y的最高价氧化物对应的水化物的酸性比X的最高价软化物对应的水化物的酸性强:
c.X.Y形成的气态氢化物中Y的气态氮化物较稳定.
①m+2 ②m+8 ③m+10 ④m+16.
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ①②③④ |
| A. | Li+、Na+、Al3+、K+ | B. | F2、Cl2、Br2、I2 | C. | F-、Cl-、Br-、I- | D. | Li、Na、K、Rb |
| A. | NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+) | B. | NaHA:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) | ||
| C. | Na2A:c(Na+)>c(A2-)>c(OH-)>c(H+) | D. | H2A:c(H+)=c(HA-)+2c(A2-)-c(OH-) |
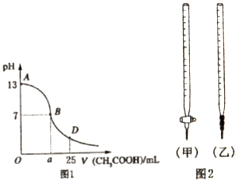
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?否(选填“是”或“否”).若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?AB区间(若正确,此问不答).
(2)关于该滴定实验,从下列选项中选出最恰当的一项A(选填字母).
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 酚酞 | (甲) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 石蕊 | (乙) |
| D | 酸 | 碱 | 石蕊 | (乙) |
A.c(OH-)大于c(CH3COO-)B.c(OH-)小于c(CH3COO-)
C.c(OH-)等于c(CH3COO-)D.上述三种情况都可以
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+)(填“>”“<”或“=”).
II.t℃时,某稀硫酸溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13:
(5)该温度下水的离子积常数KW的数值为10-13.
(6)该温度下(t℃),将100mL 0.1mol/L的稀H2SO4与100mL 0.4mol/L的NaOH溶液混合(溶液体积变化忽略不计),溶液的pH=12.
