题目内容
10.下列各项中的两个量,其比值一定为2:1的是( )| A. | 相同温度下,0.2mol•L-1醋酸溶液与0.1mol•L-1醋酸中的c(H+ )之比 | |
| B. | 在Na2O2晶体中阳离子与阴离子的物质的量之比 | |
| C. | 液面均在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛溶液的体积之比 | |
| D. | 22.4LCO2与22.4L CO所含氧原子数目之比 |
分析 A.醋酸的浓度不同,电离程度不同;
B.过氧化钠由Na+和O22-构成;
C.滴定管是精确量具,液面在0刻度,但最大刻度下的管内还有液体,50mL滴定管比25mL滴定管中的液体一定多;
D.气体存在的条件未知,不能确定物质的量关系.
解答 解:A.醋酸为弱酸,浓度不同,电离程度不同,浓度越大,电离程度越小,则相同温度下,0.2mol•L-1醋酸溶液与0.1mol•L-1醋酸中的c(H+ )之比小于2:1,故A错误;
B.过氧化钠由Na+和O22-构成,阳离子和阴离子的个数比值为2:1,故B正确;
C.25mL滴定管和50mL滴定管的管径不同,滴定管刻度线下没有刻度,但充满液体,所以体积不是1:2,故C错误;
D.气体存在的条件未知,不能确定物质的量关系,故D错误.
故选B.
点评 本题考查较为综合,涉及浓硫酸的性质,离子晶体的结构、离子浓度大小比较以及弱电解质的电离等问题,综合考查学生的分析能力,为高考常见题型,难度不大.

练习册系列答案
相关题目
10.下列各组物质中,用分液漏斗可以将其分开的是( )
| A. | 甲苯和苯酚 | B. | 乙醇和乙醛 | C. | 硝基苯和水 | D. | 乙酸和乙酸乙酯 |
18.化学反应终点的判断是化学实验的重要环节,下列对化学反应终点判断不正确的是( )
| A. | 向BaCl2溶液中加入适量Na2CO3溶液后,静置,向上层清液中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀 | |
| B. | 淀粉在稀硫酸的作用下水解后,加入NaOH使溶液呈碱性,加入新制Cu(OH)2后加热,若有砖红色沉淀生成,说明淀粉已经完全水解 | |
| C. | 将Na2SO4•10H2O晶体置于坩埚中加热,冷却后称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水 | |
| D. | 用酸式滴定管向滴有酚酞的NaOH溶液中滴加标准HCl溶液,若滴入最后一滴HCl溶液后粉红色刚好褪去,且半分钟内不变色,说明已达滴定终点 |
5.下列各种醇中能够发生消去反应生成具有相同碳原子数的烯的是( )
| A. | CH3OH | B. | 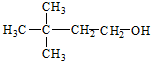 | ||
| C. | 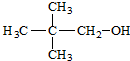 | D. | 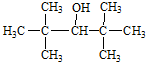 |
15.含有4个原子核,10个电子的微粒是( )
| A. | CH4 | B. | NH4+ | C. | H3O+ | D. | PH3 |
2.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的元素名称是碳,元素Z的离子结构示意图为
(2)元素W的单质燃烧后生成淡黄色固体的化学方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2
(3)元素Y与氢元素形成一种离子YH4+,则检测溶液中存在该离子的方法是取溶液少许,向溶液中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+
(4)Z元素最高价氧化物对应的水化物与W元素最高价氧化物对应的水化物的溶液反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(5)元素X与元素Y相比.非金属性较强的是N(填元素符号),下列表述中证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同:
b.Y的最高价氧化物对应的水化物的酸性比X的最高价软化物对应的水化物的酸性强:
c.X.Y形成的气态氢化物中Y的气态氮化物较稳定.
| 元素 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的金属阳离子中半径最小 |
| W | 单质制成的高压灯,发出的黄光透雾力强、射程远.且其单质燃烧后生成淡黄色固体 |

(2)元素W的单质燃烧后生成淡黄色固体的化学方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2
(3)元素Y与氢元素形成一种离子YH4+,则检测溶液中存在该离子的方法是取溶液少许,向溶液中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+
(4)Z元素最高价氧化物对应的水化物与W元素最高价氧化物对应的水化物的溶液反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(5)元素X与元素Y相比.非金属性较强的是N(填元素符号),下列表述中证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同:
b.Y的最高价氧化物对应的水化物的酸性比X的最高价软化物对应的水化物的酸性强:
c.X.Y形成的气态氢化物中Y的气态氮化物较稳定.
19.短周期的同族元素,A和B,B的原子序数比A大,若A的原子序数为m,B的原子序数为n,则n可以是( )
①m+2 ②m+8 ③m+10 ④m+16.
①m+2 ②m+8 ③m+10 ④m+16.
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ①②③④ |
20.二元酸H2A在水中的电离情况是:H2A=H++HA-和HA-?H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系错误的是( )
| A. | NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+) | B. | NaHA:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) | ||
| C. | Na2A:c(Na+)>c(A2-)>c(OH-)>c(H+) | D. | H2A:c(H+)=c(HA-)+2c(A2-)-c(OH-) |
