题目内容
5.下列热化学方程式或离子方程式中,正确的是( )| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$\frac{\underline{\;\;\;\;\;催化剂\;\;\;\;\;}}{500℃30MPa}$ 2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3 |
分析 A、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
B、0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,相同条件下的同一可逆反应,正逆反应反应热数值相等,符合相反;
C、一水合氨为弱电解质,不能写成氢氧根离子;
D、氧化铝溶于氢氧化钠生成偏氯酸钠.
解答 解:A、甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ•mol-1 ,符合燃烧热概念,故A正确;
B、相同条件下的同一可逆反应,正逆反应反应热数值相等,符合相反,0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,所以生成2mol氨气,放出的热量大于38.6kJ,故B错误;
C、一水合氨为弱电解质,不能写成氢氧根离子,离子方程式为:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+,故C错误;
D、氧化铝溶于氢氧化钠生成偏氯酸钠,Al2O3+2OH-═2AlO2-+H2O,故D错误;
故选A.
点评 本题考查反应热、离子方程式、可逆反应,难度中等,注意CD选项中产物分析和弱电解质的判断.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
15.含有4个原子核,10个电子的微粒是( )
| A. | CH4 | B. | NH4+ | C. | H3O+ | D. | PH3 |
16.随着核电荷数的递增,氧化性逐渐减弱的一组是( )
| A. | Li+、Na+、Al3+、K+ | B. | F2、Cl2、Br2、I2 | C. | F-、Cl-、Br-、I- | D. | Li、Na、K、Rb |
20.二元酸H2A在水中的电离情况是:H2A=H++HA-和HA-?H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系错误的是( )
| A. | NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+) | B. | NaHA:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) | ||
| C. | Na2A:c(Na+)>c(A2-)>c(OH-)>c(H+) | D. | H2A:c(H+)=c(HA-)+2c(A2-)-c(OH-) |
10.下列说法正确的是( )
| A. | HF比HCl稳定是由于HF分子间存在氢键所引起的 | |
| B. | 水在结冰时密度变小是由于水分子间存在氢键所引起的 | |
| C. | CH4分子很稳定,是由于分子间氢键的存在而导致的 | |
| D. | 离子化合物肯定含有金属元素,故在微粒间不存在共价键 |
17.25℃时将等体积盐酸和氨水混合,若混合溶液中[NH4+]=[Cl-],则溶液的pH值( )
| A. | >7 | B. | <7 | C. | =7 | D. | 不能确定 |
14.下列关于离子反应的说法中正确的是( )
| A. | 硫酸亚铁加过氧化氢溶液离子方程式为:Fe2++H2O2+2H+═Fe3++2H2O | |
| B. | 碘水中通入足量的SO2离子方程式为:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 在碳酸氢钠溶液中:K+、Al3+、SO42-、Cl-可大量共存 | |
| D. | 使紫色石蕊试液呈红色的溶液中:Na+、K+、CO32-、NO3-可大量共存 |
15.某有机物的结构简式如图所示,关于该物质的叙述错误的是( )
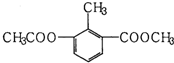

| A. | 一个分子中含有12个H原子 | |
| B. | 能使酸性KMnO4溶液褪色 | |
| C. | 苯环上的一氯代物有2种 | |
| D. | 1mol该物质分别与足量H2、NaOH溶液反应,消耗其物质的量均为3mol |



