题目内容
12.乙酸和乙烯的混合物,若其中氧的质量分数为a,则碳的质量分数是( )| A. | $\frac{1}{7}$(1-a) | B. | $\frac{3}{4}$a | C. | $\frac{6}{7}$ (1-a) | D. | $\frac{12}{13}$ (1-a) |
分析 乙酸的化学式为C2H4O2,乙烯的分子式为C2H4,则在混合物中C、H原子数目之比为1:2,则C、H元素质量之比=12:2=6:1,混合物中一共有三种元素,氧的质量分数为a,则碳、氢元素的质量分数之和为1-a,然后根据C、H元素质量之比可计算出碳元素的质量分数.
解答 解:乙酸的化学式为C2H4O2,乙烯的分子式为C2H4,则在混合物中C、H原子数目之比为1:2,则C、H元素质量之比=12:2=6:1,混合物中一共有三种元素,氧的质量分数为a,则碳、氢元素的质量分数之和为1-a,则化合物中碳元素质量分数=(1-a)×$\frac{6}{6+1}$=$\frac{6(1-a)}{7}$,
故选C.
点评 本题考查混合物中元素质量分数计算,涉及化学式的有关计算,理解混合物中碳、氢的固定组成是解答的关键,较好的训练学生分析问题、解决问题的能力.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案
相关题目
2.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的元素名称是碳,元素Z的离子结构示意图为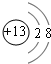
(2)元素W的单质燃烧后生成淡黄色固体的化学方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2
(3)元素Y与氢元素形成一种离子YH4+,则检测溶液中存在该离子的方法是取溶液少许,向溶液中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+
(4)Z元素最高价氧化物对应的水化物与W元素最高价氧化物对应的水化物的溶液反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(5)元素X与元素Y相比.非金属性较强的是N(填元素符号),下列表述中证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同:
b.Y的最高价氧化物对应的水化物的酸性比X的最高价软化物对应的水化物的酸性强:
c.X.Y形成的气态氢化物中Y的气态氮化物较稳定.
| 元素 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的金属阳离子中半径最小 |
| W | 单质制成的高压灯,发出的黄光透雾力强、射程远.且其单质燃烧后生成淡黄色固体 |

(2)元素W的单质燃烧后生成淡黄色固体的化学方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2
(3)元素Y与氢元素形成一种离子YH4+,则检测溶液中存在该离子的方法是取溶液少许,向溶液中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+
(4)Z元素最高价氧化物对应的水化物与W元素最高价氧化物对应的水化物的溶液反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
(5)元素X与元素Y相比.非金属性较强的是N(填元素符号),下列表述中证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同:
b.Y的最高价氧化物对应的水化物的酸性比X的最高价软化物对应的水化物的酸性强:
c.X.Y形成的气态氢化物中Y的气态氮化物较稳定.
20.二元酸H2A在水中的电离情况是:H2A=H++HA-和HA-?H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系错误的是( )
| A. | NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+) | B. | NaHA:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) | ||
| C. | Na2A:c(Na+)>c(A2-)>c(OH-)>c(H+) | D. | H2A:c(H+)=c(HA-)+2c(A2-)-c(OH-) |
7.能够用键的强度解释的是( )
| A. | N2的化学性质比O2稳定 | B. | HNO3易挥发,H2SO4难挥发 | ||
| C. | 常温、常压下,溴呈液态,碘呈固态 | D. | 稀有气体很难发生化学反应 |
17.25℃时将等体积盐酸和氨水混合,若混合溶液中[NH4+]=[Cl-],则溶液的pH值( )
| A. | >7 | B. | <7 | C. | =7 | D. | 不能确定 |
4.把①蔗糖,②淀粉,③纤维素,④乙酸乙酯在稀硫酸存在下分别进行水解,最终产物只有1种的是( )
| A. | ①和② | B. | 只有③ | C. | 只有④ | D. | 只有②和③ |
1.I.如图1为向25mL 0.1mol/L NaOH溶液中逐滴滴加0.2mol/LCH3COOH溶液过程中溶液pH的变化曲线.请回答:
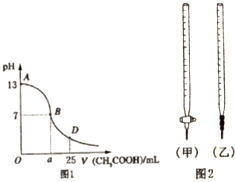
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?否(选填“是”或“否”).若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?AB区间(若正确,此问不答).
(2)关于该滴定实验,从下列选项中选出最恰当的一项A(选填字母).
(3)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是D.
A.c(OH-)大于c(CH3COO-)B.c(OH-)小于c(CH3COO-)
C.c(OH-)等于c(CH3COO-)D.上述三种情况都可以
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+)(填“>”“<”或“=”).
II.t℃时,某稀硫酸溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13:
(5)该温度下水的离子积常数KW的数值为10-13.
(6)该温度下(t℃),将100mL 0.1mol/L的稀H2SO4与100mL 0.4mol/L的NaOH溶液混合(溶液体积变化忽略不计),溶液的pH=12.

(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确?否(选填“是”或“否”).若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内?AB区间(若正确,此问不答).
(2)关于该滴定实验,从下列选项中选出最恰当的一项A(选填字母).
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 酚酞 | (甲) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 石蕊 | (乙) |
| D | 酸 | 碱 | 石蕊 | (乙) |
A.c(OH-)大于c(CH3COO-)B.c(OH-)小于c(CH3COO-)
C.c(OH-)等于c(CH3COO-)D.上述三种情况都可以
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH)=2c(Na+)(填“>”“<”或“=”).
II.t℃时,某稀硫酸溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=13:
(5)该温度下水的离子积常数KW的数值为10-13.
(6)该温度下(t℃),将100mL 0.1mol/L的稀H2SO4与100mL 0.4mol/L的NaOH溶液混合(溶液体积变化忽略不计),溶液的pH=12.
2.取代反应是有机化学中一类重要的反应,下列反应属于取代反应的是( )
| A. | 甲烷与氯气在光照的作用下生成一氯甲烷的反应 | |
| B. | 乙烯与溴的四氯化碳溶液生成溴乙烷的反应 | |
| C. | 乙烯与水生成乙醇的反应 | |
| D. | 乙烯自身生成聚乙烯的反应 |