题目内容
8.下列化学用语表达正确的是( )| A. | 环已烷的结构简式 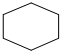 | B. | C2H4的球棍模型 | ||
| C. | 四氯化碳的电子式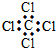 | D. | 苯的分子式 |
分析 A.环己烷分子为含有1个六元环的环烷烃;
B. 为C2H4的比例模型;
为C2H4的比例模型;
C.氯原子漏掉孤对电子;
D.分子式中应标明C和H的个数.
解答 解:A.环已烷的结构简式  ,故A正确;
,故A正确;
B.C2H4的球棍模型为: ,故B错误;
,故B错误;
C.四氯化碳分子中含有4个碳氯键,碳原子和氯原子最外层达到8电子稳定结构,四氯化碳正确的电子式为: ,故C错误;
,故C错误;
D.苯的分子式为:C6H6, 此为其结构简式,故D错误,故选A.
此为其结构简式,故D错误,故选A.
点评 本题考查了电子式、结构简式、比例模型、球棍模型的表示方法判断,熟悉相关化学用语是解题关键,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
18.化学反应终点的判断是化学实验的重要环节,下列对化学反应终点判断不正确的是( )
| A. | 向BaCl2溶液中加入适量Na2CO3溶液后,静置,向上层清液中继续滴加Na2CO3溶液,若无沉淀,说明Ba2+已经完全沉淀 | |
| B. | 淀粉在稀硫酸的作用下水解后,加入NaOH使溶液呈碱性,加入新制Cu(OH)2后加热,若有砖红色沉淀生成,说明淀粉已经完全水解 | |
| C. | 将Na2SO4•10H2O晶体置于坩埚中加热,冷却后称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水 | |
| D. | 用酸式滴定管向滴有酚酞的NaOH溶液中滴加标准HCl溶液,若滴入最后一滴HCl溶液后粉红色刚好褪去,且半分钟内不变色,说明已达滴定终点 |
19.短周期的同族元素,A和B,B的原子序数比A大,若A的原子序数为m,B的原子序数为n,则n可以是( )
①m+2 ②m+8 ③m+10 ④m+16.
①m+2 ②m+8 ③m+10 ④m+16.
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ①②③④ |
16.随着核电荷数的递增,氧化性逐渐减弱的一组是( )
| A. | Li+、Na+、Al3+、K+ | B. | F2、Cl2、Br2、I2 | C. | F-、Cl-、Br-、I- | D. | Li、Na、K、Rb |
20.二元酸H2A在水中的电离情况是:H2A=H++HA-和HA-?H++A2-,则下列物质的水溶液中粒子浓度之间存在的关系错误的是( )
| A. | NaHA:c(Na+)>c(HA-)>c(OH-)>c(H+) | B. | NaHA:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) | ||
| C. | Na2A:c(Na+)>c(A2-)>c(OH-)>c(H+) | D. | H2A:c(H+)=c(HA-)+2c(A2-)-c(OH-) |
17.25℃时将等体积盐酸和氨水混合,若混合溶液中[NH4+]=[Cl-],则溶液的pH值( )
| A. | >7 | B. | <7 | C. | =7 | D. | 不能确定 |
18.短周期主族元素X、Y、Z、W的原子序数依次增大,已知X、Y、Z+、W各微粒最外层电子数与其电子层数之比值依次为2、3、4、2,下列有关这四种元素叙述正确的是( )
| A. | Y与X、Z、W分别能形成两种化合物 | |
| B. | Z与W形成的Z2W型化合物在水溶液中Z+离子与W2-离子个数比为2:1 | |
| C. | Y、Z、W不可能形成水溶液呈碱性的化合物 | |
| D. | 化合物X Y2、X YW、X W2随着共价键的键长逐渐增大,熔沸点逐渐降低 |



