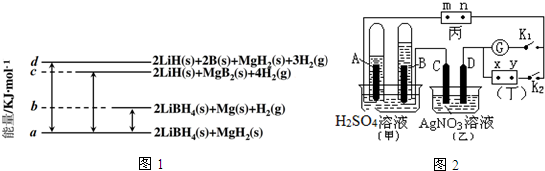题目内容
14.下列关于物质性质变化的比较,不正确的是( )| A. | 酸性强弱:H2SiO3<H2CO3<HNO3 | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 非金属性强弱:I>Cl>F |
分析 A.元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
B.同主族元素从上到下,元素半径逐渐增大,同一周期,原子序数越大,半径越小;
C.元素的金属性越强,对应的最高价氧化物的碱性越强;
D.同族元素,原子序数越大,非金属性越弱.
解答 解:A.非金属性N>C>Si,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故A正确;
B.同主族元素从上到下,元素半径逐渐增大,同一周期,原子序数逐渐减小,即Na>S>O,故B正确;
C.金属性K>Na>Li,则碱性KOH>NaOH>LiOH,故C正确;
D.同族元素,原子序数越大,非金属性越弱,即F>Cl>I,故D错误.故选D.
点评 本题考查元素周期律的递变规律,侧重于学生的分析能力和基本概念的综合理解和运用的考查,注意把握元素与对应单质、化合物的性质的相似性和递变性的判断,注重基础知识的积累,难度不大.

练习册系列答案
相关题目
5. 央视焦点访谈节目在2010年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
央视焦点访谈节目在2010年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
 央视焦点访谈节目在2010年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
央视焦点访谈节目在2010年10月报道,俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | 该有机物的分子式为C7H10O3 | |
| B. | 1mol该有机物最多能与2mol H2发生加成反应 | |
| C. | 该有机物的一种芳香族同分异构体能发生银镜反应 | |
| D. | 该有机物能发生取代、加成、氧化和还原反应 |
2.在2L容积不变的容器中,发生N2+3H2?2NH3的反应.现通入4mol H2和4mol N2,10s内用H2表示的反应速率为0.12mol/(L•s),则10s后容器中N2的物质的量是( )
| A. | 1.6 mol | B. | 2.8 mol | C. | 3.2 mol | D. | 3.6 mol |
6.下表为元素周期表的一部分,a、b、c…为部分元素.回答下列问题:
(1)请写出上述元素d3+的核外电子排布式1s222s2p63s23p63d5;
(2)请写出j的单质与a、h形成的化合物发生反应的化学方程式Cl2+H2O=HCl+HClO;
(3)请比较b、e、j三种元素的电负性由大到小的顺序Cl>Al>Mg(写元素符号);此三种元素的第一电离能由大到小的顺序Cl>Mg>Al(写元素符号);
(4)g、e两种元素的最高价氧化物对应的水合物的化学性质相似,请写出e元素最高价氧化物对应的水合物与a、c、h三种元素形成的化合物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O;
(5)j、k、l三种元素之间能以原子个数比1:1两两形成互化物,这些互化物的性质类似于这些元素单质的性质.请写出k、l的互化物的电子式 ,它是由δ键(根据原子轨道的重叠程度填写)形成的共价化合物(填“离子”或“共价”).
,它是由δ键(根据原子轨道的重叠程度填写)形成的共价化合物(填“离子”或“共价”).
| a | |||||||||||||||||
| f | h | i | |||||||||||||||
| b | e | j | |||||||||||||||
| c | d | g | k | ||||||||||||||
| l | |||||||||||||||||
(2)请写出j的单质与a、h形成的化合物发生反应的化学方程式Cl2+H2O=HCl+HClO;
(3)请比较b、e、j三种元素的电负性由大到小的顺序Cl>Al>Mg(写元素符号);此三种元素的第一电离能由大到小的顺序Cl>Mg>Al(写元素符号);
(4)g、e两种元素的最高价氧化物对应的水合物的化学性质相似,请写出e元素最高价氧化物对应的水合物与a、c、h三种元素形成的化合物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O;
(5)j、k、l三种元素之间能以原子个数比1:1两两形成互化物,这些互化物的性质类似于这些元素单质的性质.请写出k、l的互化物的电子式
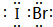 ,它是由δ键(根据原子轨道的重叠程度填写)形成的共价化合物(填“离子”或“共价”).
,它是由δ键(根据原子轨道的重叠程度填写)形成的共价化合物(填“离子”或“共价”).
4.下列物质的电子式书写正确的是( )
| A. | 氯化氢  | B. | 二氧化碳  | ||
| C. | 氮气  | D. | 氯化镁  |
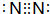 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.