题目内容
4.A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,A和E同主族,且原子的最外层电子数的关系为A+D=B+F=8.请回答:(1)试写出B2单质的电子式:
 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.(2)含F元素对应的金属阳离子的溶液中滴加过量E的最高价氧化物对应水化物的溶液,其离子方程式是Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O.
(3)已知B2A4与BA3具有相似的性质,B2A4通过炽热的氧化铜粉末,粉末由黑色变为红色,且产物对大气无污染,其化学反应方程式是N2H4+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2+2H2O.
(4)在2L的密闭容器中,通入2mol B2气体和3mol A2气体,一定温度下反应生成BA3气体,当反应达到平衡时,A2的浓度为0.15mol•L-1,同时放出约83.2kJ的热量,该反应的热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ•mol-1.
(5)已知某化合物EB3与水可以反应生成两种气体单质和一种碱,试写出其化学方程式2NaN3+2H2O═3N2↑+H2↑+2NaOH;若0.1mol该化合物完全反应,转移电子的物质的量为0.1mol.
分析 A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,为10电子微粒,A和E同主族,则E只能处于第三周期,故B为N元素、C为O元素、D为F元素;原子的最外层电子数的关系为A+D=B+F=8,则A原子最外层电子数为1,F原子最外层电子数为3,则A、E处于IA族,故E为Na,F处于ⅢA族,故F为Al,结合(4)A可以形成A2气体,A为H元素,据此解答.
解答 解:A、B、C、D、E、F为常见的原子序数依次增大的短周期元素,B、C、D、E、F的简单离子的电子层结构相同,为10电子微粒,A和E同主族,则E只能处于第三周期,故B为N元素、C为O元素、D为F元素;原子的最外层电子数的关系为A+D=B+F=8,则A原子最外层电子数为1,F原子最外层电子数为3,则A、E处于IA族,故E为Na,F处于ⅢA族,故F为Al,结合(4)A可以形成A2气体,A为H元素.
(1)N2单质的电子式: ,由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式为H2O2,故答案为:
,由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式为H2O2,故答案为: ;H2O2;
;H2O2;
(2)E的最高价氧化物对应水化物为NaOH,向含有Al3+离子的溶液中滴加过量NaOH的溶液,其离子方程式是:Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O;
(3)N2H4通过炽热的氧化铜粉末,粉末由黑色变为红色,且产物对大气无污染,反应生成Cu、氮气与水,化学反应方程式是:N2H4+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2+2H2O,
故答案为:N2H4+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+N2+2H2O;
(4)在2L的密闭容器中,通入2mol N2气体和3mol H2气体,一定温度下反应生成NH3气体,当反应达到平衡时,H2的浓度为0.15mol•L-1,同时放出约83.2kJ的热量,则参加反应氢气为3mol-0.15mol/L×2L=2.7mol,故3mol氢气反应放出的热量为83.2kJ×$\frac{3mol}{2.7mol}$=92.4kJ,该反应的热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ•mol-1,
故答案为:N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ•mol-1;
(5)化合物NaN3与水可以反应生成两种气体单质和一种碱,应生成氮气、氢气与氢氧化钠,其化学方程式为:2NaN3+2H2O═3N2↑+H2↑+2NaOH,若0.1mol该NaN3完全反应,N元素平均化合价由-$\frac{1}{3}$升高为0价,故转移电子的物质的量为0.1mol×3×$\frac{1}{3}$=0.1mol,
故答案为:2NaN3+2H2O═3N2↑+H2↑+2NaOH;0.1mol.
点评 本题考查元素推断、常用化学用语书写、电子转移计算等,注意掌握常见10电子离子,是对学生综合能力的考查,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 工艺师可利用氢氟酸刻蚀石英制作艺术品,说明氢氟酸的酸性很强 | |
| B. | 水晶项链和光导纤维的主要成分是相同的 | |
| C. | 粗硅的制备及提纯单晶硅均涉及到氧化还原反应 | |
| D. | 我国自主研发的“龙芯1号”CPU芯片与神舟六号飞船使用的太阳能电池都用到硅 |
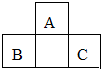 短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
短周期元素A、B、C的位置如图所示,已知B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )| A. | Be、Na、Al | B. | C、Al、P | C. | B、Mg、Si | D. | O、P、Cl |
| A. | 32克O2所含的原子数目为2NA | |
| B. | 1mol Cl2与1mol H2反应转移电子数目为2NA | |
| C. | 标准状况下,22.4L水中含有NA个水分子 | |
| D. | 20g重水所含的电子数目为10NA |
①两容器内原子总数相同 ②两容器内分子总数相同
③乙中N(H2):N(N2)=3:1 ④两容器内N(H):N(N)=3:1.
| A. | ①②③④ | B. | ①②③ | C. | ②③④ | D. | 只有② |
| A. | 新制Cu(OH)2悬浊液 | B. | 溴水 | C. | 酸性KMnO4溶液 | D. | NaOH溶液 |
| A. | BaO2(过氧化钡)固体中的阳离子和阴离子 | |
| B. | ${\;}_{1}^{2}$H中的中子和质子 | |
| C. | NaHCO3中的阳离子和阴离子 | |
| D. | 4Be2+中的质子和电子 |
| A. | 判断一种元素是金属还是非金属 | B. | 判断化合物中元素的化合价 | ||
| C. | 判断化学键类型 | D. | 判断化合物的溶解度 |
| A. | 酸性强弱:H2SiO3<H2CO3<HNO3 | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 非金属性强弱:I>Cl>F |