题目内容
2.在2L容积不变的容器中,发生N2+3H2?2NH3的反应.现通入4mol H2和4mol N2,10s内用H2表示的反应速率为0.12mol/(L•s),则10s后容器中N2的物质的量是( )| A. | 1.6 mol | B. | 2.8 mol | C. | 3.2 mol | D. | 3.6 mol |
分析 根据速率之比等于其化学计量数之比计算氮气表示的速率,计算参加反应的氮气的物质的量,进而计算10s后氮气物质的量.
解答 解:10s内用H2表示的反应速率为0.12mol/(L•s),
则v(N2)=$\frac{1}{3}$v(H2)=$\frac{1}{3}$×0.12mol/(L•s)=0.04mol/(L•s),
故参加反应的氮气为:0.04mol/(L•s)×10s×2L=0.8mol,
故10s后容器中N2的物质的量是:4mol-0.8mol=3.2mol,
故选:C.
点评 本题考查化学反应速率的有关计算,难度不大,注意对公式的理解与灵活应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列有关阿伏伽德罗常数(NA)的说法错误的是( )
| A. | 32克O2所含的原子数目为2NA | |
| B. | 1mol Cl2与1mol H2反应转移电子数目为2NA | |
| C. | 标准状况下,22.4L水中含有NA个水分子 | |
| D. | 20g重水所含的电子数目为10NA |
13.下列不是元素电负性应用的是( )
| A. | 判断一种元素是金属还是非金属 | B. | 判断化合物中元素的化合价 | ||
| C. | 判断化学键类型 | D. | 判断化合物的溶解度 |
7.下列实验中,不能观察到明显变化的是( )
| A. | 把一段打磨过的镁带放入少量冷水中 | |
| B. | 把 Cl2通入FeCl2溶液中 | |
| C. | 把绿豆大的钾投入水中 | |
| D. | 氢氟酸滴到玻璃上 |
14.下列关于物质性质变化的比较,不正确的是( )
| A. | 酸性强弱:H2SiO3<H2CO3<HNO3 | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 非金属性强弱:I>Cl>F |
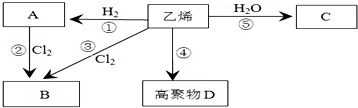
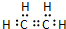 ,分子中含有的共价键类型有非极性键、极性键(填极性键或非极性键). C中含官能团名称羟基;
,分子中含有的共价键类型有非极性键、极性键(填极性键或非极性键). C中含官能团名称羟基;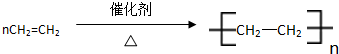 ,反应类型:加聚反应.⑤CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,反应类型:加成反应.
,反应类型:加聚反应.⑤CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,反应类型:加成反应.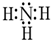 ,分子间存在氢键.
,分子间存在氢键.