题目内容
9.能源与材料、信息被称为现代社会发展的三大支柱,化学与能源有着密切联系.(1)如图1是21LiBH4/MgH2体系放氢焓变示意图,则Mg(s)+2B(s)═MgB2(s)△H=(a+c-b-d)kJ•mol-1(用代数式表示).
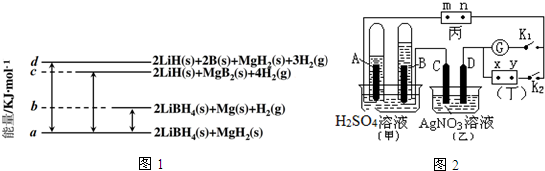
(2)以甲醚(CH3-O-CH3)、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为CH3OCH3+16OH-12e-=2CO2-3+11H2O.已知参与电极反应的电极材料单位质量放出电能的多少称为该电池的比能量,关于甲醚碱性燃料电池与乙醇(CH3CH2OH)碱性燃料电池的下列说法中正确的是D(填序号).
A.两种燃料所含化学建类型完全相同 B.两种燃料的燃烧热相同
C.两种燃料电池的比能量相同 D.两种燃料电池的正极反应式相同
(3)如图2所示的实验装置中,丙为用碘化钾溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹;丁为直流电源,x、y为电源的两极;G为电流计;A、B、C、D四个电极均为石墨电极.若在两试管中充满H2SO4溶液后倒立于H2SO4溶液的水槽中,闭合K2,断开K1.
①x为电源丁的正极.
②丙电解时反应的离子方程式为2I-+2H2O$\frac{\underline{\;通电\;}}{\;}$I2+H2↑+2OH-.
③继续电解一段时间后,甲池中A、B极均部分被气体包围,此时断开K2,闭合K1,电流计G指针发生偏转,则B极的电极反应式为O2+4e-+4H+=2H2O,C极的电极反应式为4OH-+4e-=O2↑+2H2O.
分析 (1)根据反应热的意义,由图可知:
2LiBH4(s)=2LiH(s)+2B(s)+3H2(g)△H=+(d-a) kJ•mol-1①
MgH2(s)=Mg(s))+H2(g)△H=+(b-a)kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+(c-a) kJ•mol-1③
应用盖斯定律计算化学反应的焓变;
(2)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,原电池反应比直接燃烧能量转化率高;二甲醚与乙醇的结构不同,所以含有的共价键的种类不同,断键时吸收的能量不同;
(3)闭合K2,断开K1时,该甲、乙、丙为电解装置,据电解硫酸溶液时生成氢气和氧气的体积可以判断电源的正负极;电解KI溶液时,据离子的放电顺序书写电解方程式;甲池中A、B极均部分被气体包围时,断开K2,闭合K1,甲为原电池乙为电解池,据此分析.
解答 解:(1)由图可知:
2LiBH4(s)=2LiH(s)+2B(s)+3H2(g)△H=+(d-a) kJ•mol-1①
MgH2(s)=Mg(s))+H2(g)△H=+(b-a)kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+(c-a) kJ•mol-1③
据盖斯定律③-①-②得:Mg(s)+2B(s)═MgB2(s)△H=+(a+c-b-d)kJ•mol-1
故答案为:(a+c-b-d) kJ•mol-1;
(2)原电池负极发生氧化反应,甲醚在负极放电,碱性条件下生成碳酸根与水,电极反应式为:CH3OCH3+16OH--12e-=2CO32-+11H2O,
两种燃料所含共价键数目相同,但是共价键种类不同,所以断键时所需能量不相同,所以燃烧热不同,比能量不相同,但正极上都是氧气反应,电极反应式相同,所以ABC错误,D正确;故答案为:CH3OCH3+16OH-12e-=2CO2-3+11H2O;D;
(3)闭合K2,断开K1时,该甲、乙、丙为电解装置,据电解硫酸溶液时生成氢气和氧气的体积可以判断,A为阴极,氢离子在阴极放电生成氢气,B为阳极,氢氧根离子在阳极放电生成氧气,所以x为电源的正极;电解KI溶液时,碘离子和氢离子分别在两极放电,电解的离子方程式为2I-+2H2O $\frac{\underline{\;通电\;}}{\;}$I2+H2↑+2OH-;甲池中A、B极均部分被气体包围时,断开K2,闭合K1,甲为原电池乙为电解池,B电极是正极,氧气在正极反应,在酸性环境中反应的电极反应式为O2+4e-+4H+=2H2O,C电极为阳极,氢氧根离子在阳极放电生成氧气,电极反应式为4OH-+4e-=O2↑+2H2O,故答案为:正;2I-+2H2O $\frac{\underline{\;通电\;}}{\;}$I2+H2↑+2OH-;O2+4e-+4H+=2H2O;4OH-+4e-=O2↑+2H2O.
点评 本题考查了盖斯定律的应用、原电池原理阳极电极反应式书写、电解原理以及电极反应式书写,注意电解质溶液中离子的放电顺序,题目难度较大.

①两容器内原子总数相同 ②两容器内分子总数相同
③乙中N(H2):N(N2)=3:1 ④两容器内N(H):N(N)=3:1.
| A. | ①②③④ | B. | ①②③ | C. | ②③④ | D. | 只有② |
①混合物:盐酸、漂白粉、水玻璃、水银
②化合物:CaCl2、NaOH、HCl、HD
③电解质:明矾、石膏、冰醋酸、氯化银
④同素异形体:C60、C70、金刚石、石墨.
| A. | ①③④ | B. | ②③④ | C. | ③④ | D. | ①④ |
| A. | 酸性强弱:H2SiO3<H2CO3<HNO3 | B. | 原子半径大小:Na>S>O | ||
| C. | 碱性强弱:KOH>NaOH>LiOH | D. | 非金属性强弱:I>Cl>F |
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | CH3OH的燃烧热为192.9 kJ•mol-1 | |
| B. | 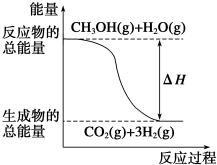 反应①中的能量变化如图所示 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9 kJ•mol-1 |
| A. | 实验操作:制乙炔用饱和食盐水代替水,实验目的:加快化学反应速率 | |
| B. | 实验操作:C2H4与SO2混合气体通过盛有溴水的洗气瓶,实验目的:除去C2H4中的SO2 | |
| C. | 实验操作:淀粉溶液水解后冷却至温室,加碘水观察现象,实验目的:检验淀粉是否水解完全 | |
| D. | 实验操作:将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液,实验目的:检验溴乙烷中的溴原子 |
