题目内容
11.几种短周期元素的原子半径及主要化合价如下表:| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A. | 离子半径大小:Y2->M2->R3+ | |
| B. | Y与M组成的化合物是形成酸雨的原因之一 | |
| C. | 将YM2通入BaCl2溶液中有大量白色沉淀产生 | |
| D. | X的最高价氧化物的水化物碱性大于R最高价氧化物的水化物碱性 |
分析 由化合价可知Y化合价有+6、-2价,应为ⅥA族元素,为S元素,M化合价只有-2价,为O元素,Z化合价为+5、-3,为ⅤA族元素,因原子半径大于O,应为N元素,X化合价为+1价,为ⅠA族元素,原子半径大于S,为Na元素,R为+3价,属于ⅢA族元素,原子半径小于Na,大于S,为Al元素,结合对应单质、化合物的性质解答该题.
解答 解:由化合价可知Y化合价有+6、-2价,应为ⅥA族元素,为S元素,M化合价只有-2价,为O元素,Z化合价为+5、-3,为ⅤA族元素,因原子半径大于O,应为N元素,X化合价为+1价,为ⅠA族元素,原子半径大于S,为Na元素,R为+3价,属于ⅢA族元素,原子半径小于Na,大于S,为Al元素,
A.同主族元素从上到下简单离子半径逐渐增大,M2-、R3+具有相同的核外电子排布,核电荷数越大离子半径越小,则M2->R3+,故A正确;
B.Y与M组成的化合物为SO2,可形成酸雨,故B正确;
C.亚硫酸酸性比盐酸弱,SO2与BaCl2溶液不反应,故C错误;
D.金属性Na>Al,元素的金属性越强,对应的最高价氧化物的水化物碱性越强,故D正确.
故选C.
点评 本题考查结构性质位置关系应用,为高频考点,侧重于学生的分析能力的考查,利用原子半径及化合价来推断元素是解答本题的关键,难度中等.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案
相关题目
2.下列化学用语表示正确的是( )
| A. | 氯化钙的化学式 CaCl | B. | HCl分子的电子式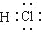 | ||
| C. | 氯化钠的电子式 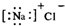 | D. | 氯原子的结构示意图 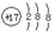 |
16.C8H8O2符合下列要求的同分异构体种类( )
①属于芳香族化合物②能与新制氢氧化铜溶液反应③能与氢氧化钠溶液反应.
①属于芳香族化合物②能与新制氢氧化铜溶液反应③能与氢氧化钠溶液反应.
| A. | 10 | B. | 21 | C. | 14 | D. | 17 |
3.有机物在生活中的应用非常广泛.下列有关说法正确的是( )
| A. | 食用植物油均可水解生成氨基酸 | |
| B. | 铺路用的沥青主要含有C、H、O等元素 | |
| C. | 做衣服的棉、麻的主要成分是纤维素 | |
| D. | 煤经过汽化、液化等物理变化可转化为清洁燃料 |
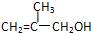 ,
,
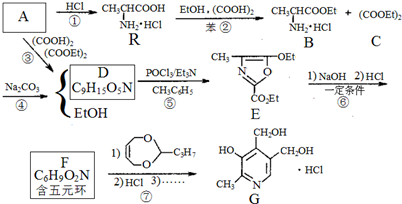
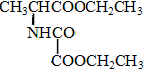 、F
、F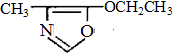 .
.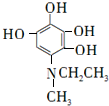 等.
等. .
.