题目内容
20.(1)我国某地区已探明蕴藏有丰富的赤铁矿(主要成分为Fe2O3,还含有SiO2等杂质)、煤矿、石灰石和黏土.拟在该地区建设大型炼铁厂.①随着铁矿的开发和炼铁厂的建立,需要在该地区相应建立焦化厂、发电厂、水泥厂等,形成规模的工业体系.据此确定图1中相应工厂的名称:
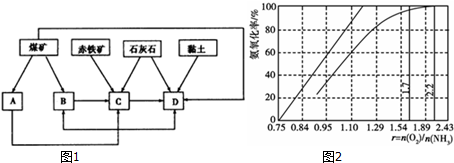
A.发电厂,B.焦化厂,C.炼铁厂,D.水泥厂;
②以赤铁矿为原料,写出高炉炼铁中得到生铁和产生炉渣的化学方程式:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2、CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑.
(2)玻璃钢可由酚醛树脂和玻璃纤维制成.
①酚醛树脂由酚醛和甲醛缩聚而成,反应有大量热放出,为防止温度过高,应向有苯酚的反应釜间歇性的加入甲醛,且反应釜应装有散热装置.
②玻璃钢中玻璃纤维的作用是增强体.玻璃钢具有强度高、质量轻(或耐腐蚀、抗冲击、绝缘性能好)等优异性能(写出两点即可).
③下列处理废旧热固性酚醛塑料的做法合理的是bc.
a.深埋 b.粉碎后用作树脂填料 c.用作燃料 d.用有机溶剂将其溶解,回收树脂
(3)工业上主要采用氨氧化法生产硝酸,如图2是氨氧化率与氨-空气混合气中氧氨比的关系.其中直线表示反应的理论值;曲线表示生产实际情况.当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=1.25,实际生产要将r值维持在1.7~2.2之间,原因是O2浓度太少不利于NH3的转化,r{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%.
分析 (1)①煤炭燃烧可以发电,煤的干馏制造煤焦油,赤铁矿、碳酸钙是炼铁的原料,碳酸钙和黏土是生产水泥的原料;
②高炉炼铁中得到生铁的方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2、CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑;
(2)①反应物投入的物质的量越多放出的热越多;
②玻璃钢是将玻璃纤维和高分子材料复合而成的复合材料,其中玻璃纤维的作用是增强体,合成材料是基体,它的优点有:强度高、质量轻、耐腐蚀、抗冲击、绝缘性能好等;
③废旧合成材料的再生利用主要有三条途径:通过再生和改性,重新做成多种有用的材料和制品;采用热裂解或化学处理方法使其分解,用于制备多种化工原料;将废旧的聚合物作为燃料回收利用热能;
(3)根据氨氧化的化学方程式来分析;根据O2浓度太少不利于NH3的转化分析.
解答 解:(1)①煤炭燃烧可以发电,A为发电厂,煤的干馏制造煤焦油,B为焦化厂,赤铁矿、碳酸钙是炼铁的原料,C为炼铁厂,碳酸钙和黏土是生产水泥的原料,D为水泥厂,
故答案为:发电厂;焦化厂;炼铁厂;水泥厂;
②高炉炼铁中得到生铁的方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,产生炉渣的方程式为CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,
故答案为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2、CaCO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑;
(2)①苯酚和甲醛发生缩聚反应,反应有大量热放出,为防止温度过高,应向已有苯酚的反应釜中间歇性的加入甲醛,并装有散热装置,故答案为:间歇性;散热;
②玻璃钢是将玻璃纤维和高分子材料复合而成的复合材料,其中玻璃纤维的作用是增强体,合成材料是基体,它的优点有:强度高、质量轻、耐腐蚀、抗冲击、绝缘性能好等,故答案为:增强体;强度高、质量轻(或耐腐蚀、抗冲击、绝缘性能好);
③废旧合成材料的再生利用主要有三条途径:通过再生和改性,重新做成多种有用的材料和制品;采用热裂解或化学处理方法使其分解,用于制备多种化工原料;将废旧的聚合物作为燃料回收利用热能,塑料深埋很久不会腐烂,会造成白色污染,酚醛塑料不能溶于有机溶剂,故选bc;
(3)由氨氧化的化学方程式:4NH3+5O2$\frac{\underline{\;\;\;催化剂\;\;\;}}{高温高压}$4NO+6H2O,可知氨氧化率达到100%,理论上r{n(O2)/n(NH3)}=$\frac{5}{4}$=1.25,O2浓度太少不利于NH3的转化,γ{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%,
故答案为:1.25;O2浓度太少不利于NH3的转化,r{n(O2)/n(NH3)值为2.2时NH3氧化率已近100%.
点评 本题考查金属冶炼,涉及到氧化还原方程式的书写,题目难度中等,本题注意从题目中获取信息,结合物质的性质解答.

(1)PM2.5常吸附含有砷的化合物等有毒致癌物质,砷的元素符号为As,位于元素周期表第四周期第ⅤA族.
(2)将PM2.5样本用蒸馏水处理成待测液,测得所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(3)室温下,用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化如下表:
| N(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
(4)已知:2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
一定条件下,将NO和SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是b.
a.体系压强保持不变 b.混合气体颜色保持不变 c.SO3和NO的体积保持不变 d.每消耗1molSO3的同时生成1molNO2.
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A. | 离子半径大小:Y2->M2->R3+ | |
| B. | Y与M组成的化合物是形成酸雨的原因之一 | |
| C. | 将YM2通入BaCl2溶液中有大量白色沉淀产生 | |
| D. | X的最高价氧化物的水化物碱性大于R最高价氧化物的水化物碱性 |
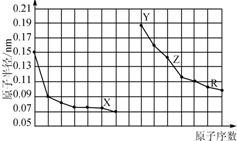
| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:X>Y>Z | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
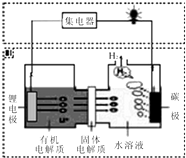 近几年科学家发明的一种新型可控电池--锂水电池,工作原理如图所示.下列有关说法不正确的是( )
近几年科学家发明的一种新型可控电池--锂水电池,工作原理如图所示.下列有关说法不正确的是( )| A. | 碳极发生的反应是:2H2O+2e-=H2↑+2OH - | |
| B. | 有机电解质和水溶液不可以互换区域 | |
| C. | 标况下产生22.4L的氢气时,正极消耗锂的质量为14g | |
| D. | 该装置不仅可提供电能,还可得到清洁的氢气 |
①化学键只存在分子之内
②离子化合物中不可能含非极性键
③共价化合物中不可能含离子键
④由非金属元素形成的化合物都是共价化合物
⑤强电解质一定是离子化合物
⑥共价化合物可以是非电解质
⑦稳定性:H2O>H2S,跟氢键有关.
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)③的元素符号是Li,⑧的最高价氧化物对应水化物是Al(OH)3.
①在元素周期表中的位置是(周期、族)第二周期ⅥA族.
(2)碱性最强的化合物的电子式是:
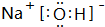 ;属离子化合物(填“离子”或“共价”).
;属离子化合物(填“离子”或“共价”).(3)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O.
 .
.