题目内容
2.下列化学用语表示正确的是( )| A. | 氯化钙的化学式 CaCl | B. | HCl分子的电子式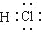 | ||
| C. | 氯化钠的电子式 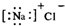 | D. | 氯原子的结构示意图 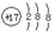 |
分析 A.钙离子带有两个正电荷,而氯离子带有1个负电荷,正电荷不为0,所以离子个数比错误;
B.HCl为共价化合物,形成一对共用电子对;
C.氯离子为阴离子,电子式中需要标出氯离子的最外层电子;
D.氯原子的最外层有7个电子.
解答 解:氯化钙正确的化学式为CaCl2,故A错误;
B.氯化氢为共价化合物,分子中存在1个氢氯键,HCl的电子式为 ,故B正确;
,故B正确;
C.氯化钠为离子化合物,钠离子直接用离子符号表示,氯离子需要标出最外层电子及所带电荷,氯化钠正确的电子式为: ,故C错误;
,故C错误;
D.Cl的质子数为17,最外层电子为7,则氯原子的结构示意图为: ,故D错误;
,故D错误;
故选B.
点评 本题考查了电子式、化学式、原子结构示意图等化学用语的判断,题目难度中等,注意掌握常见化学用语的概念及书写原则,明确离子化合物与共价化合物的电子式的区别,试题侧重考查学生规范答题能力.

练习册系列答案
相关题目
12.下列关于材料的说法中,正确的是( )
| A. | 硅的提纯与应用,促进了半导体元件与集成芯片的发展 | |
| B. | 水泥、玻璃、塑料都是高分子材料 | |
| C. | 钢化玻璃与普通玻璃的主要成分不同 | |
| D. | 通常情况下,铝合金在空气中不易被腐蚀,可用做建筑材料 |
10.研究PM2.5、SO2、NO2等大气污染物具有重要意义,请回答下列问题:
(1)PM2.5常吸附含有砷的化合物等有毒致癌物质,砷的元素符号为As,位于元素周期表第四周期第ⅤA族.
(2)将PM2.5样本用蒸馏水处理成待测液,测得所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断待浊溶液的pH=4.
(3)室温下,用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化如下表:
由上表判断NaHSO3溶液显酸性,用化学平衡原理解释:HSO3-存在:HSO3-?SO32-+H+和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度.
(4)已知:2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
一定条件下,将NO和SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是b.
a.体系压强保持不变 b.混合气体颜色保持不变 c.SO3和NO的体积保持不变 d.每消耗1molSO3的同时生成1molNO2.
(1)PM2.5常吸附含有砷的化合物等有毒致癌物质,砷的元素符号为As,位于元素周期表第四周期第ⅤA族.
(2)将PM2.5样本用蒸馏水处理成待测液,测得所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(3)室温下,用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化如下表:
| N(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
(4)已知:2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
一定条件下,将NO和SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是b.
a.体系压强保持不变 b.混合气体颜色保持不变 c.SO3和NO的体积保持不变 d.每消耗1molSO3的同时生成1molNO2.
17.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 碳酸钙受热分解 | B. | 乙醇燃烧 | ||
| C. | 铝粉与盐酸的反应 | D. | 氧化钙溶于水 |
14.在一定温度下,可逆A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | V(C):V(B)=2:3 | |
| B. | 单位时间生成nmolA,同时生成3nmolB | |
| C. | A、B、C的体积分数不再变化 | |
| D. | A、B、C的分子数比为1:3:2 |
11.几种短周期元素的原子半径及主要化合价如下表:
已知X是短周期中最活泼的金属,且与R同周期.下列叙述不正确的是( )
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A. | 离子半径大小:Y2->M2->R3+ | |
| B. | Y与M组成的化合物是形成酸雨的原因之一 | |
| C. | 将YM2通入BaCl2溶液中有大量白色沉淀产生 | |
| D. | X的最高价氧化物的水化物碱性大于R最高价氧化物的水化物碱性 |
 ),是一种重要的有机化工原料.根据题意完成下列填空:
),是一种重要的有机化工原料.根据题意完成下列填空: $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$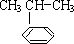 ,反应类型为加成反应
,反应类型为加成反应 如图所示,是原电池的装置图.请回答:
如图所示,是原电池的装置图.请回答: