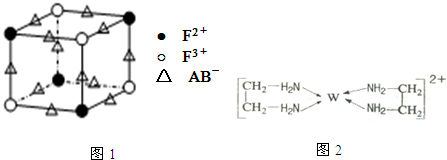题目内容
19.现有①CaBr2 ②金刚石 ③铜 ④干冰 ⑤Na2SO4 ⑥碘片 ⑦NH4Cl ⑧二氧化硅八种物质,按下列要求回答(填序号):(1)晶体熔化时需要破坏共价键的是②⑧,熔点最低的是④.
(2)只含有离子键的物质是①.
(3)属于共价化合物的是④⑧,可以通过怎样的事实证明上述结论:熔融状态下不导电.
(4)晶体中只存在一种微粒间作用力是①②⑧.
分析 ①CaBr2中只含离子键,为离子化合物;
②金刚石中构成微粒为原子,只含共价键,为原子晶体;
③铜中含金属键,为金属晶体;
④干冰中含共价键,构成微粒为分子,为分子晶体;
⑤Na2SO4中含离子键和共价键,为离子化合物;
⑥碘片中含共价键,构成微粒为分子,为分子晶体;
⑦NH4Cl中含离子键和共价键,为离子化合物;
⑧二氧化硅中构成微粒为原子,只含共价键,为原子晶体,以此来解答.
解答 解:(1)原子晶体熔化时需要破坏共价键,金刚石和晶体硅都属于原子晶体,所以熔化时需要破坏共价键的是②⑧;分子晶体的熔点与其相对分子质量成正比,相对分子质量越小,该分子晶体的熔点越低,干冰和碘都属于分子晶体,二氧化碳的相对分子质量小于碘,所以干冰的沸点最低,故选④;
故答案为:②⑧;④;
(2)溴化钙、硫酸钠、氯化铵中均含离子键,但只含离子键的为①CaBr2,故答案为:①;
(3)属于共价化合物的是④⑧,熔融状态下不导电可证明,故答案为:④⑧;熔融状态下不导电;
(4)晶体中只存在一种微粒间作用力是①(只含离子键)、②⑧(只含共价键),故答案为:①②⑧.
点评 本题考查化学键及晶体中存在的作用力,为高频考点,把握晶体的构成微粒及微粒间的作用力及化学键的判断为解答的关键,注意分子晶体中含分子间作用力,题目难度不大.

练习册系列答案
相关题目
9.分子式为C8H8O2,苯环上只有两个取代基,且能发生银镜反应的所有同分异构体种数为( )
| A. | 3 | B. | 6 | C. | 9 | D. | 12 |
10.研究PM2.5、SO2、NO2等大气污染物具有重要意义,请回答下列问题:
(1)PM2.5常吸附含有砷的化合物等有毒致癌物质,砷的元素符号为As,位于元素周期表第四周期第ⅤA族.
(2)将PM2.5样本用蒸馏水处理成待测液,测得所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断待浊溶液的pH=4.
(3)室温下,用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化如下表:
由上表判断NaHSO3溶液显酸性,用化学平衡原理解释:HSO3-存在:HSO3-?SO32-+H+和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度.
(4)已知:2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
一定条件下,将NO和SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是b.
a.体系压强保持不变 b.混合气体颜色保持不变 c.SO3和NO的体积保持不变 d.每消耗1molSO3的同时生成1molNO2.
(1)PM2.5常吸附含有砷的化合物等有毒致癌物质,砷的元素符号为As,位于元素周期表第四周期第ⅤA族.
(2)将PM2.5样本用蒸馏水处理成待测液,测得所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(3)室温下,用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化如下表:
| N(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
(4)已知:2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8kJ•mol-1.
一定条件下,将NO和SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是b.
a.体系压强保持不变 b.混合气体颜色保持不变 c.SO3和NO的体积保持不变 d.每消耗1molSO3的同时生成1molNO2.
14.在一定温度下,可逆A(g)+3B(g)?2C(g)达到平衡的标志是( )
| A. | V(C):V(B)=2:3 | |
| B. | 单位时间生成nmolA,同时生成3nmolB | |
| C. | A、B、C的体积分数不再变化 | |
| D. | A、B、C的分子数比为1:3:2 |
4.下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是( )
| A. | 异戊二烯( )与等物质的量的Br2发生加成反应 )与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷(CH3CHClCH2CH3)与NaOH乙醇溶液共热 | |
| C. | 甲苯在一定条件下发生硝化生成一硝基甲苯的反应 | |
| D. | 甲醇在铜催化和加热条件下生成的产物 |
11.几种短周期元素的原子半径及主要化合价如下表:
已知X是短周期中最活泼的金属,且与R同周期.下列叙述不正确的是( )
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A. | 离子半径大小:Y2->M2->R3+ | |
| B. | Y与M组成的化合物是形成酸雨的原因之一 | |
| C. | 将YM2通入BaCl2溶液中有大量白色沉淀产生 | |
| D. | X的最高价氧化物的水化物碱性大于R最高价氧化物的水化物碱性 |
8.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法错误的是( )
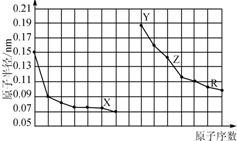

| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:X>Y>Z | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
 如图所示,是原电池的装置图.请回答:
如图所示,是原电池的装置图.请回答: .
.