题目内容
2.下表是元素周期表的一部分,根据要求回答下列问题.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | H | F | I | ||||
| 3 | A | C | D | G | R | |||
| 4 | B |
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH(填化学式).
(3)I元素跟A元素形成化合物的电子式是
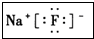 .并用电子式表示该化合物的形成过程_
.并用电子式表示该化合物的形成过程_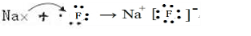
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
分析 依据元素周期表可知字母分别代表的元素为:A:钠,B:钾,C:镁,D:铝,E:碳,F:氧,G:氯,H:氮,I:氟,R:氩,
(1)0族元素最不活泼;
(2)金属性越强,其对应最高价氧化物的水化物的碱性越强;
(3)NaF是离子化合物,用电子式表示其形成过程时,左边是原子的电子式,右边为氯化钠的电子式;
(4)氯气与氢氧化钾法生成氯化钾和次氯酸钾,据此书写离子反应方程式即可;
(5)过氧化钠较稳定,与二氧化碳反应生成碳酸钠和氧气,据此书写.
解答 解:依据元素周期表可知字母分别代表的元素为:A:钠,B:钾,C:镁,D:铝,E:碳,F:氧,G:氯,H:氮,I:氟,R:氩,
(1)Ar为惰性气体,最外层满足了8个电子的稳定结构,最不活泼,故答案为:Ar;
(2)A,C,D三种元素分别对应的水化物为 NaOH、Mg(OH)2、Al(OH)3其中NaOH碱性最强,故答案为:NaOH;
(3)NaF为离子化合物,电子式为: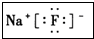 ,用电子式表示的形成过程为
,用电子式表示的形成过程为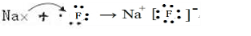 ,
,
故答案为: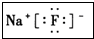 ;
;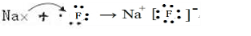 ;
;
(4)B的最高价氧化物对应的水化物为强碱KOH,完全电离,故反应方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(5)A与F形成Na2O与Na2O2两种物质,其中过氧化钠更稳定,过氧化钠与二氧化碳反应生成碳酸钠和氧气,化学反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2.
点评 本题主要考查的是元素周期表的应用以及元素的推断和元素化合物的知识,涉及电子式的书写和用电子式表示离子化合物的形成过程,难度不大.

练习册系列答案
相关题目
3.下列实验操作错误的是( )
| A. | 蒸馏时,应使冷却水下进上出 | |
| B. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 将浓H2SO4和酒精混合时,应将H2SO4慢慢加到酒精中,并及时搅拌和冷却 |
4.同一周期元素中,非金属性最强的元素位于( )
| A. | 0族 | B. | 第ⅠA族 | C. | 第ⅣA族 | D. | 第ⅦA族 |
1.恒温下,将NO2装入带活塞的密闭容器中,当反应2NO2(g)?N2O4(g)达到平衡后,慢慢压缩气体体积,使体积减小一半,下列叙述正确的是( )
| A. | 压强为原来的两倍 | B. | 平衡向右移动,混合气体颜色变浅 | ||
| C. | 压强增大,但小于原来的两倍 | D. | 平衡向右移动,混合气体密度增大 |
8.能正确表示下列化学反应的离子方程式的是( )
| A. | 氢氧化钡溶液与硫酸的反应:OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 铝片溶于氢氧化钠溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
7.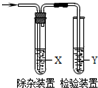 用下列方法制备乙烯并用如图所示装置检验乙烯时不需要除杂的是( )
用下列方法制备乙烯并用如图所示装置检验乙烯时不需要除杂的是( )
 用下列方法制备乙烯并用如图所示装置检验乙烯时不需要除杂的是( )
用下列方法制备乙烯并用如图所示装置检验乙烯时不需要除杂的是( )| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | 水 | Br2的CCl4溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | 水 | KMnO4酸性溶液 |
| C | C2H5OH与浓H2SO4 | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4 | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
11.下列反应可能会生成Na2O2的是( )
| A. | 金属钠高温还原CO2,制人工金刚石膜或粉 | |
| B. | 汽车气囊中用氧化铁除去NaN3受撞击时分解生成的钠 | |
| C. | 隔绝空气条件下加热金属钠与NaNO2反应制取Na2O | |
| D. | 将4.6 g钠与1.6g硫粉迅速混合起来,并放在石棉网上加热 |
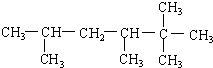 2,2,3,5-四甲基己烷
2,2,3,5-四甲基己烷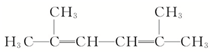 2,5-二甲基-2,4-己二烯.
2,5-二甲基-2,4-己二烯.