题目内容
1.恒温下,将NO2装入带活塞的密闭容器中,当反应2NO2(g)?N2O4(g)达到平衡后,慢慢压缩气体体积,使体积减小一半,下列叙述正确的是( )| A. | 压强为原来的两倍 | B. | 平衡向右移动,混合气体颜色变浅 | ||
| C. | 压强增大,但小于原来的两倍 | D. | 平衡向右移动,混合气体密度增大 |
分析 A、体积减小一半,压强增大一倍,但平衡向气体体积减少的方向移动,最后达到平衡;
B、压强增大,正逆反应速率都增大,平衡向气体体积减少的方向移动;
C、压强增大平衡向气体体积减少的方向移动,体积改变为主;
D、混合气体质量守恒,气体物质的量减小.
解答 解:将NO2装入带活塞的密闭容器中,当反应2NO2(g)?N2O4(g)达到平衡后,慢慢压缩气体体积,压强增大平衡正向移动;
A、体积减小一半,压强增大,平衡正向移动,小于原来的两倍,故A错误;
B、体积减小,NO2浓度增加,混合气体颜色变深,虽然平衡向右移动,但以体积改变为主,混合气体颜色会变深,故B错误;
C、体积减小一半,压强增大,V正增大,V逆增大,平衡正向移动,小于原来的两倍,故C正确;
D、体积减小一半,平衡向右移动,混合气体质量守恒,气体密度增大,故D错误;
故选C.
点评 本题考查了化学平衡的影响因素和应用,主要是恒压容器中化学平衡的变化,掌握分析方法和平衡移动原理是解题关键,题目难度中等.

练习册系列答案
相关题目
11.反应A(g)+3B(g)═2C(g)+2D(g)在四种不同情况下的反应速率可分别为①v(A)=0.15mol/(L•s) ②v(B)=36mol/(L•min) ③v(C)=0.4mol/(L•s) ④v(D)=0.45mol/(L•s)该反应进行的快慢顺序为.( )
| A. | ④>③=②>① | B. | ④>③>②>① | C. | ②>④>③>① | D. | ②>③=④>① |
9.下列说法正确的是( )
| A. | 增加水的量或提高温度都可以加快镁和水的反应速率 | |
| B. | 增加硝酸的浓度可以加快锌与硝酸反应制氢气的速率 | |
| C. | 蒸干氯化铁溶液能够得到氯化铁固体 | |
| D. | 增加气态反应物的物质的量,未必增大其反应速率 |
16.在pH=13的无色溶液中,可以大量共存的离子组是( )
| A. | Ba2+ Na+ Cl- SO42- | B. | K+ Na+ Cl- CO32- | ||
| C. | K+ NH4+ SO32- NO3- | D. | K+ CO32- MnO4- AlO2- |
6.在稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是( )
| A. | 溶液中的SO42-向正极运动 | B. | 电子通过导线由铜片流向锌片 | ||
| C. | 正极有O2逸出 | D. | 铜片上有H2逸出 |
2.下表是元素周期表的一部分,根据要求回答下列问题.
(1)十种元素中化学性质最不活泼的元素是Ar(填元素符号).
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH(填化学式).
(3)I元素跟A元素形成化合物的电子式是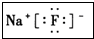 .并用电子式表示该化合物的形成过程_
.并用电子式表示该化合物的形成过程_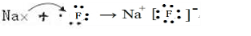
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | H | F | I | ||||
| 3 | A | C | D | G | R | |||
| 4 | B |
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH(填化学式).
(3)I元素跟A元素形成化合物的电子式是
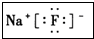 .并用电子式表示该化合物的形成过程_
.并用电子式表示该化合物的形成过程_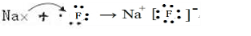
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
19.下列说法正确的是(NA为阿伏加德罗常数的值)( )
| A. | 常温、常压下,11.2 L N2含有的分子数为0.5NA | |
| B. | 常温常压下,1mol氦气含有的原子数为NA | |
| C. | 71gCl2所含原子数为2NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含分子数和原子数都相等 |
20.浩瀚的海洋是一个巨大的宝库,海水就是一项等待开发的资源.海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3- 等离子.合理利用水资源是持续发展的重要保证.
Ⅰ:火力发电是广东的重要能源,但是烧煤排放的SO2会造成一系列环境问题.利用海水脱硫是一种有效地方法.其工艺流程如下图所示:

(1天然海水pH≈7.9,呈弱碱性.用离子方程式解释其原因CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-(写一个).
(2)天然海水吸收含硫的烟气后,需要用氧气进行氧化处理,其反应原理的化学反应方程式是2H2SO3+O2=2H2SO4;氧化后的海水需要加入氢氧化钠,与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+).
Ⅱ:微量的重金属污染,可以通过生物链作用而产生富集.当人因为饮用或食用受重金属污染的水和食物,体内重金属含量过高时,便会导致各种疾病.某酸性化工废水中含有浓度约为0.01mol.L-1的Ag+、Pb2+等重金属离子.有关数据如下:
(3)在废水排放前,用沉淀法除去这两种离子,应该加入B(填字母序号)最好
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)某工程师用CaO处理上述废水,最终溶液的pH=8,请你计算处理后废水中Pb2+的浓度为1.2×10-9mol•L-1.
Ⅰ:火力发电是广东的重要能源,但是烧煤排放的SO2会造成一系列环境问题.利用海水脱硫是一种有效地方法.其工艺流程如下图所示:

(1天然海水pH≈7.9,呈弱碱性.用离子方程式解释其原因CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-(写一个).
(2)天然海水吸收含硫的烟气后,需要用氧气进行氧化处理,其反应原理的化学反应方程式是2H2SO3+O2=2H2SO4;氧化后的海水需要加入氢氧化钠,与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+).
Ⅱ:微量的重金属污染,可以通过生物链作用而产生富集.当人因为饮用或食用受重金属污染的水和食物,体内重金属含量过高时,便会导致各种疾病.某酸性化工废水中含有浓度约为0.01mol.L-1的Ag+、Pb2+等重金属离子.有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)某工程师用CaO处理上述废水,最终溶液的pH=8,请你计算处理后废水中Pb2+的浓度为1.2×10-9mol•L-1.
