题目内容
14.Ⅰ写出下列反应的离子方程式(1)用小苏打溶液除去CO2中的HCl:HCO3-+H+=H2O+CO2↑;
(2)向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O;
(3)用醋酸除去水壶中的水垢:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑;
Ⅱ把下列离子方程式改写成化学方程式:
(1)CO32-+2H+=CO2↑+H2ONa2CO3+2HCl=NaCl+CO2↑+H2O;
(2)Ag++Cl-=AgCl↓AgNO3+NaCl=AgCl+NaNO3.
分析 I.(1)小苏打与HCl反应生成氯化钠、水和二氧化碳;
(2)逐滴加入Ba(OH)2溶液至中性,生成硫酸钡、硫酸钠和水;
(3)醋酸与碳酸钙反应生成醋酸钙、水和二氧化碳;
Ⅱ.(1)表示可溶性碳酸盐与强酸反应生成可溶性盐、水、二氧化碳的反应;
(2)表示硝酸银与盐酸或可溶性盐酸盐的反应.
解答 解:Ⅰ.(1)小苏打与HCl反应生成氯化钠、水和二氧化碳,离子反应为HCO3-+H+=H2O+CO2↑,故答案为:HCO3-+H+=H2O+CO2↑;
(2)逐滴加入Ba(OH)2溶液至中性,生成硫酸钡、硫酸钠和水,离子反应为2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O,
故答案为:2H++SO42-+2OH-+Ba2+=BaSO4↓+2H2O;
(3)醋酸与碳酸钙反应生成醋酸钙、水和二氧化碳,离子反应为CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑,
故答案为:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑;
Ⅱ.(1)表示可溶性碳酸盐与强酸反应生成可溶性盐、水、二氧化碳的反应,如Na2CO3+2HCl=NaCl+CO2↑+H2O(答案不唯一),
故答案为:Na2CO3+2HCl=NaCl+CO2↑+H2O;
(2)表示硝酸银与盐酸或可溶性盐酸盐的反应,如AgNO3+NaCl=AgCl+NaNO3(答案不唯一),故答案为:AgNO3+NaCl=AgCl+NaNO3.
点评 本题考查离子反应方程式的书写及意义,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
15.在含有CO32-的无色溶液中,能大量共存的离子组是( )
| A. | K+ MnO4- NO3-Na+ | B. | Na+NH4+Ba2+K+ | ||
| C. | Na+SO32-SO42-K+ | D. | K+Ca2+NO3-K+ |
16.在pH=13的无色溶液中,可以大量共存的离子组是( )
| A. | Ba2+ Na+ Cl- SO42- | B. | K+ Na+ Cl- CO32- | ||
| C. | K+ NH4+ SO32- NO3- | D. | K+ CO32- MnO4- AlO2- |
2.下表是元素周期表的一部分,根据要求回答下列问题.
(1)十种元素中化学性质最不活泼的元素是Ar(填元素符号).
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH(填化学式).
(3)I元素跟A元素形成化合物的电子式是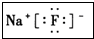 .并用电子式表示该化合物的形成过程_
.并用电子式表示该化合物的形成过程_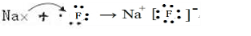
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | H | F | I | ||||
| 3 | A | C | D | G | R | |||
| 4 | B |
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH(填化学式).
(3)I元素跟A元素形成化合物的电子式是
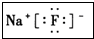 .并用电子式表示该化合物的形成过程_
.并用电子式表示该化合物的形成过程_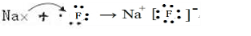
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
19.下列说法正确的是(NA为阿伏加德罗常数的值)( )
| A. | 常温、常压下,11.2 L N2含有的分子数为0.5NA | |
| B. | 常温常压下,1mol氦气含有的原子数为NA | |
| C. | 71gCl2所含原子数为2NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含分子数和原子数都相等 |
6.下列能源中,不属于可再生能源的是( )
| A. | 沼气 | B. | 风能 | C. | 天然气 | D. | 潮汐能 |
3.下列说法正确的是(NA为阿伏加德罗常数)( )
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 12 g石墨中含有C-C键的个数为1.5NA | |
| C. | 28 g晶体硅中含有Si-Si键的个数为4NA | |
| D. | 60 g SiO2中含Si-O键的个数为2NA |
4.将x mol氧气,y mol甲烷和z mol过氧化钠放入密闭容器中,在150℃条件下用点火花引发,恰好完全反应后,容器内压强为0,确立x:y:z之间的关系式为( )
| A. | 2:1:6 | B. | 3:2:6 | C. | 1:2:5 | D. | 1:2:6 |