题目内容
12.(采用系统命名法)写出下列各烃的名称(1)(CH3)2CH(CH2)2CH(C2H5)(CH2)2CH32-甲基-5-乙基辛烷
(2)
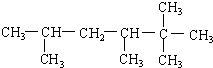 2,2,3,5-四甲基己烷
2,2,3,5-四甲基己烷(3)
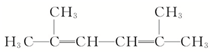 2,5-二甲基-2,4-己二烯.
2,5-二甲基-2,4-己二烯.
分析 烷烃的命名原则:碳链最长称某烷,靠近支链把号编.简单在前同相并,其间应划一短线;
烯烃的命名原则:选取含有碳碳双键的最长碳链为主链,选取距离双键最近的一端命名为1号碳.
解答 解:(1)(CH3)2CH(CH2)2CH(C2H5)(CH2)2CH3 的最长碳链为8,在2号碳上含有1个甲基,在5号碳上含有1个乙基,正确命名为:2-甲基-5-乙基辛烷,故答案为:2-甲基-5-乙基辛烷;
(2)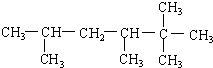 的最长碳链为6,从右端命名,在2号碳上含有2个甲基,在3和5号碳山河各含有1个甲基,正确命名为:2,2,3,5-四甲基己烷,故答案为:2,2,3,5-四甲基己烷;
的最长碳链为6,从右端命名,在2号碳上含有2个甲基,在3和5号碳山河各含有1个甲基,正确命名为:2,2,3,5-四甲基己烷,故答案为:2,2,3,5-四甲基己烷;
(3)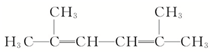 含有2个碳碳双键,为二烯烃,最长碳链为6,为对称结构,在2和5号碳上含有1个甲基,碳碳双键分别在2、3号碳和4、5号碳之间,正确命名为:2,5-二甲基-2,4-己二烯,故答案为:2,5-二甲基-2,4-己二烯.
含有2个碳碳双键,为二烯烃,最长碳链为6,为对称结构,在2和5号碳上含有1个甲基,碳碳双键分别在2、3号碳和4、5号碳之间,正确命名为:2,5-二甲基-2,4-己二烯,故答案为:2,5-二甲基-2,4-己二烯.
点评 本题考查了烷烃和烯烃的系统命名法,题目难度中等,可以根据“碳链最长称某烷,靠近支链把号编.简单在前同相并,其间应划一短线”进行命名.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
2.下表是元素周期表的一部分,根据要求回答下列问题.
(1)十种元素中化学性质最不活泼的元素是Ar(填元素符号).
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH(填化学式).
(3)I元素跟A元素形成化合物的电子式是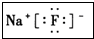 .并用电子式表示该化合物的形成过程_
.并用电子式表示该化合物的形成过程_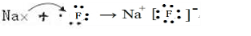
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | H | F | I | ||||
| 3 | A | C | D | G | R | |||
| 4 | B |
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH(填化学式).
(3)I元素跟A元素形成化合物的电子式是
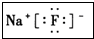 .并用电子式表示该化合物的形成过程_
.并用电子式表示该化合物的形成过程_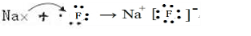
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
3.下列说法正确的是(NA为阿伏加德罗常数)( )
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 12 g石墨中含有C-C键的个数为1.5NA | |
| C. | 28 g晶体硅中含有Si-Si键的个数为4NA | |
| D. | 60 g SiO2中含Si-O键的个数为2NA |
20.浩瀚的海洋是一个巨大的宝库,海水就是一项等待开发的资源.海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3- 等离子.合理利用水资源是持续发展的重要保证.
Ⅰ:火力发电是广东的重要能源,但是烧煤排放的SO2会造成一系列环境问题.利用海水脱硫是一种有效地方法.其工艺流程如下图所示:

(1天然海水pH≈7.9,呈弱碱性.用离子方程式解释其原因CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-(写一个).
(2)天然海水吸收含硫的烟气后,需要用氧气进行氧化处理,其反应原理的化学反应方程式是2H2SO3+O2=2H2SO4;氧化后的海水需要加入氢氧化钠,与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+).
Ⅱ:微量的重金属污染,可以通过生物链作用而产生富集.当人因为饮用或食用受重金属污染的水和食物,体内重金属含量过高时,便会导致各种疾病.某酸性化工废水中含有浓度约为0.01mol.L-1的Ag+、Pb2+等重金属离子.有关数据如下:
(3)在废水排放前,用沉淀法除去这两种离子,应该加入B(填字母序号)最好
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)某工程师用CaO处理上述废水,最终溶液的pH=8,请你计算处理后废水中Pb2+的浓度为1.2×10-9mol•L-1.
Ⅰ:火力发电是广东的重要能源,但是烧煤排放的SO2会造成一系列环境问题.利用海水脱硫是一种有效地方法.其工艺流程如下图所示:

(1天然海水pH≈7.9,呈弱碱性.用离子方程式解释其原因CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-(写一个).
(2)天然海水吸收含硫的烟气后,需要用氧气进行氧化处理,其反应原理的化学反应方程式是2H2SO3+O2=2H2SO4;氧化后的海水需要加入氢氧化钠,与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+).
Ⅱ:微量的重金属污染,可以通过生物链作用而产生富集.当人因为饮用或食用受重金属污染的水和食物,体内重金属含量过高时,便会导致各种疾病.某酸性化工废水中含有浓度约为0.01mol.L-1的Ag+、Pb2+等重金属离子.有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-12 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)某工程师用CaO处理上述废水,最终溶液的pH=8,请你计算处理后废水中Pb2+的浓度为1.2×10-9mol•L-1.
7.下列物质中,既含有极性共价键,又含有非极性共价键的是( )
| A. | CCl4 | B. | C2H4 | C. | CO2 | D. | NH4Cl |
17.若用乙烯和氯气在适当的条件下反应制取四氯乙烷,这一过程中所要经历的反应及耗用氯气的量是(设乙烯为1mol,反应产物中的有机物只是四氯乙烷)( )
| A. | 取代,4 mol Cl2 | B. | 加成,2 mol Cl2 | ||
| C. | 加成、取代,2 mol Cl2 | D. | 加成、取代,3 mol Cl2 |
4.将x mol氧气,y mol甲烷和z mol过氧化钠放入密闭容器中,在150℃条件下用点火花引发,恰好完全反应后,容器内压强为0,确立x:y:z之间的关系式为( )
| A. | 2:1:6 | B. | 3:2:6 | C. | 1:2:5 | D. | 1:2:6 |
2.玻璃器皿中沾有一些用水洗不掉的下列残留物,其中能用酒精洗干净的是( )
| A. | 做有关硫的实验残留的硫 | B. | 做碘升华实验残留的碘 | ||
| C. | 用KMnO4制O2后留下的固体 | D. | 沾有AgCl沉淀的试管 |