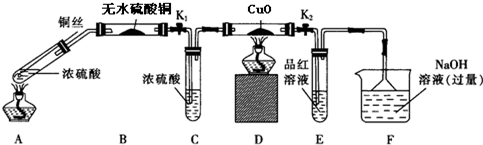
题目内容
8.能正确表示下列化学反应的离子方程式的是( )| A. | 氢氧化钡溶液与硫酸的反应:OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 铝片溶于氢氧化钠溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
分析 A.漏写生成硫酸钡的离子反应;
B.石灰水电离出离子;
C.电子、电荷不守恒;
D.反应生成偏铝酸钠和氢气,遵循电子、电荷守恒.
解答 解:A.氢氧化钡溶液与硫酸的反应的离子反应为Ba2++2OH-+SO42-+2H+═2H2O+BaSO4↓,故A错误;
B.澄清的石灰水与稀盐酸反应的离子反应为OH-+H+═H2O,故B错误;
C.铜片插入硝酸银溶液中的离子反应为Cu+2Ag+═Cu2++2Ag,故C错误;
D.铝片溶于氢氧化钠溶液中的离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
16.在pH=13的无色溶液中,可以大量共存的离子组是( )
| A. | Ba2+ Na+ Cl- SO42- | B. | K+ Na+ Cl- CO32- | ||
| C. | K+ NH4+ SO32- NO3- | D. | K+ CO32- MnO4- AlO2- |
3.将Na2O2投入FeCl2溶液中,完全反应后最终可观察到的现象是( )
| A. | 生成白色沉淀 | B. | 生成红褐色沉淀 | C. | 生成灰绿色沉淀 | D. | 有气泡产生 |
2.下表是元素周期表的一部分,根据要求回答下列问题.
(1)十种元素中化学性质最不活泼的元素是Ar(填元素符号).
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH(填化学式).
(3)I元素跟A元素形成化合物的电子式是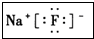 .并用电子式表示该化合物的形成过程_
.并用电子式表示该化合物的形成过程_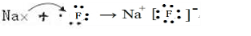
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | H | F | I | ||||
| 3 | A | C | D | G | R | |||
| 4 | B |
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH(填化学式).
(3)I元素跟A元素形成化合物的电子式是
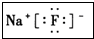 .并用电子式表示该化合物的形成过程_
.并用电子式表示该化合物的形成过程_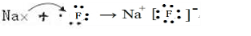
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
6.下列能源中,不属于可再生能源的是( )
| A. | 沼气 | B. | 风能 | C. | 天然气 | D. | 潮汐能 |
7.下列物质中,既含有极性共价键,又含有非极性共价键的是( )
| A. | CCl4 | B. | C2H4 | C. | CO2 | D. | NH4Cl |