题目内容
3.下列实验操作错误的是( )| A. | 蒸馏时,应使冷却水下进上出 | |
| B. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| C. | 用酒精萃取碘水中的碘 | |
| D. | 将浓H2SO4和酒精混合时,应将H2SO4慢慢加到酒精中,并及时搅拌和冷却 |
分析 A.冷凝水下进上出;
B.分液漏斗中下层液体从下口放出,上层液体从上口倒出;
C.萃取剂应不溶于水,酒精与水混溶,不能用作萃取剂;
D.浓硫酸稀释过程中放出大量的热.
解答 解:A.蒸馏时冷凝水下进上出,冷凝效果最好,故A正确;
B.为防止液体污染,分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,故B正确;
C.酒精和水互溶,则不能用酒精萃取碘水中的碘,一般选择苯或四氯化碳作萃取剂,故C错误;
D.浓硫酸稀释过程中放出大量的热,应将浓H2SO4慢慢加到酒精中,并及时搅拌和冷却,故D正确.
故选C.
点评 本题考查化学实验基本操作知识,题目难度不大,学习中要重视相关基本操作的方法和注意事项.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.化学在生产和日常生活中有着重要的作用.下列有关说法正确的是( )
| A. | 二氧化硫有漂白性,常用作棉、麻、纸张和食品的漂白 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 | |
| C. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| D. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 |
11.反应A(g)+3B(g)═2C(g)+2D(g)在四种不同情况下的反应速率可分别为①v(A)=0.15mol/(L•s) ②v(B)=36mol/(L•min) ③v(C)=0.4mol/(L•s) ④v(D)=0.45mol/(L•s)该反应进行的快慢顺序为.( )
| A. | ④>③=②>① | B. | ④>③>②>① | C. | ②>④>③>① | D. | ②>③=④>① |
8.下列反应的离子方程式中,正确的是( )
| A. | 氢氧化钡溶液和稀硫酸Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | 石灰乳与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O | |
| C. | 过量CO2通入NaOH溶液中CO2+2OH-=CO32-+H2O | |
| D. | 少量CO2通入NaOH溶液中CO2+OH-=HCO3-+H2O |
15.在含有CO32-的无色溶液中,能大量共存的离子组是( )
| A. | K+ MnO4- NO3-Na+ | B. | Na+NH4+Ba2+K+ | ||
| C. | Na+SO32-SO42-K+ | D. | K+Ca2+NO3-K+ |
2.下表是元素周期表的一部分,根据要求回答下列问题.
(1)十种元素中化学性质最不活泼的元素是Ar(填元素符号).
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH(填化学式).
(3)I元素跟A元素形成化合物的电子式是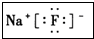 .并用电子式表示该化合物的形成过程_
.并用电子式表示该化合物的形成过程_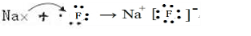
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | H | F | I | ||||
| 3 | A | C | D | G | R | |||
| 4 | B |
(2)A、C、D三种元素的氧化物对应的水化物,其中碱性最强的是NaOH(填化学式).
(3)I元素跟A元素形成化合物的电子式是
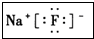 .并用电子式表示该化合物的形成过程_
.并用电子式表示该化合物的形成过程_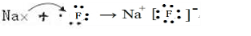
(4)G的单质和B的最高价氧化物对应水化物反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(5)元素A和F能形成两种化合物,写出其中较稳定的化合物与CO2反应生成氧气的化学方程式2Na2O2+2CO2=2Na2CO3+O2.