题目内容
7.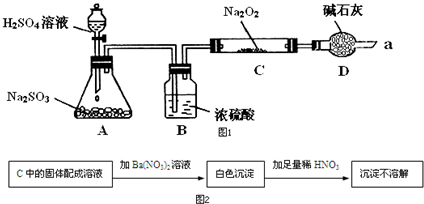 某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)
某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)Ⅰ.装置B的作用是吸收水,干燥SO2气体,其原因是(用离子方程式表示)2Na2O2+2H2O=4Na++4OH-+O2↑.装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应.
Ⅱ.某同学想通过图2实验装置,检验反应中是否有O2生成时,其实验操作步骤是:
①先打开分液漏斗上口瓶塞和下口旋塞
②再用带火星的木条靠近干燥管口a,观察其是否复燃.
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3:有Na2SO3和Na2SO4.
(1)若假设2成立,写出所发生反应的化学方程式Na2O2+SO2=Na2SO4.
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如图2实验,C中的固体配成溶液加Ba(NO3)2溶液沉淀不溶解白色沉淀加足量稀HNO3.
得出结论:产物是Na2SO4.
该方案是否合理否 (填“是”或“否”).
(3)设计实验验证假设3的实验步骤如表:
| 实验步骤 | 实验现象 |
| ①滴加入过量的稀盐酸 | 产生剌激性气味气体 |
| ②滴加入适量的BaCl2溶液 | 产生白色沉淀. |
| ③取少量C中固体产物于试管中,加入适量的蒸馏水溶解 |
分析 Ⅰ.水能和过氧化钠反应生成氢氧化钠和氧气;根据碱石灰的性质判断其作用;
Ⅱ.①要检验是否有氧气生成,必须先使分液漏斗中的硫酸进入锥形瓶参加反应生成二氧化硫.
Ⅲ.(1)根据二氧化硫的还原性和过氧化钠的氧化性分析,强氧化性的物质和强还原性的物质发生氧化还原反应,写出相应的方程式.
(2)硝酸有强氧化性,能把亚硫酸根离子氧化成硫酸根离子.
(3)要验证假设3是否成立,所做实验步骤应为:先溶解溶液,再加盐酸检验亚硫酸盐是否存在,最后加钡盐检验硫酸盐是否存在.
解答 解:Ⅰ.水能和过氧化钠反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑;
空气中含有二氧化碳和水蒸气,碱石灰是干燥剂,所以能吸收水分,防止水蒸气的干扰;碱石灰能和二氧化碳反应,防止二氧化碳的干扰,所以装置D的作用是防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应.
故答案为:2Na2O2+2H2O=4Na++4OH-+O2↑;防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应;
Ⅱ.①要检验是否有氧气生成,必须先使分液漏斗中的硫酸进入锥形瓶参加反应生成二氧化硫,所以先打开分液漏斗上口瓶塞和下口旋塞,使溶液进入锥形瓶,
故答案为:打开分液漏斗上口瓶塞和下口旋塞;
Ⅲ.假设1:只有Na2SO3; 假设2:只有Na2SO4;所以假设3为有Na2SO3和Na2SO4,故答案为:有Na2SO3和Na2SO4;
(1)二氧化硫有还原性,过氧化钠有强氧化性,所以二氧化硫能被过氧化钠氧化,二氧化硫和过氧化钠反应的方程式为:Na2O2+SO2=Na2SO4 ,
故答案为:Na2O2+SO2=Na2SO4;
(2)硝酸有强氧化性,能把亚硫酸根离子氧化成硫酸根离子,所以该方案不合理,故答案为:否;
(3)要做验证假设3的实验先溶解固体,故先选③;亚硫酸钠和硫酸钠都和氯化钡发生生成白色沉淀,导致所以无法确定假设3是否正确;先加稀盐酸,亚硫酸钠和稀盐酸发生生成刺激性气味的气体而去除亚硫酸钠,硫酸钠和稀盐酸不反应,所以就排除了亚硫酸钠的干扰,再向该溶液中加氯化钡溶液,如果生成白色沉淀,就证明该固体中含有硫酸钠,所以正确的实验操作顺序是③①②,故答案为:③①②.
点评 本题考查了二氧化硫性质的实验,难度较大,会设计探究实验,根据实验现象得出正确结论.

| A. | 2.2 mol•L-1 | B. | 4 mol•L-1 | C. | 5 mol•L-1 | D. | 6.25 mol•L-1 |
| A. | 三种元素的原子半径大小为X>Y>Z | B. | Y2-与Z+的半径大小为Y2->Z+ | ||
| C. | Y元素为S | D. | Z 元素为K |
| A. | KCl | B. | Na2O2 | C. | KOH | D. | H2O |
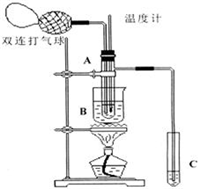 乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:
乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见下表:| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
(1)试管A内在60~80℃时发生的主要反应的化学方程式为(注明反应条件)2CH3CHO+O2$→_{CuO}^{60℃-80℃}$2CH3COOH;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在试管A的反应液中;目的是测量反应溶液的温度;当试管A内的主要反应完成后温度计水银球的位置应在试管A的支管口处,目的是收集含乙酸的馏分;
(3)烧杯B的作用是使试管A内的反应液均匀受热发生反应,使生成的乙酸变成蒸气进入试管C;烧杯B内盛装的液体可以是乙二醇(甘油)(写出一种即可,在题给物质中找);
(4)若想检验试管C中是否含有产物乙酸,请你在所提供的药品中进行选择,设计一个简便的实验方案.所提供的药品有:pH试纸、红色的石蕊试纸、白色的醋酸铅试纸、碳酸氢钠粉末.实验仪器任选.该方案为:
将少量碳酸氢钠粉未,放入一个洁净的试管中,加入少量试管C中的液体,若有气体产生,则说明试管C中含有产物乙酸(或把一块pH试纸放在表面皿(或玻璃片)上,用洁净、干燥的玻璃棒蘸取试管C内的液体,点在pH试纸中部,试纸变色后,用标准比色卡比较来确定溶液的pH,进而说明是否有乙酸生成).
 合成
合成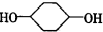 (部分试剂和反应条件已去).请回答下列问题:
(部分试剂和反应条件已去).请回答下列问题:
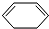 +Br$\stackrel{一定条件}{→}$
+Br$\stackrel{一定条件}{→}$ ,写出在同样条件下CH2=CH-CH=CH2与等物质的量Br发生加成反应的化学方程式:
,写出在同样条件下CH2=CH-CH=CH2与等物质的量Br发生加成反应的化学方程式: .
. F
F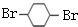 .
. ,其PMR谱中有2个信号峰,其强度之比为3:1.则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1:1:2的是BD.
,其PMR谱中有2个信号峰,其强度之比为3:1.则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1:1:2的是BD.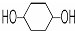 B.
B.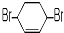 C.
C. D.
D.
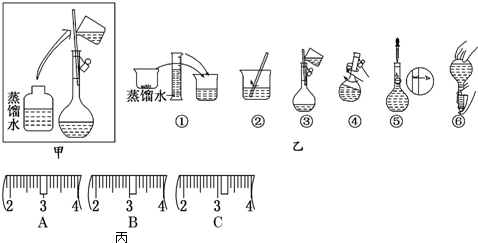
 的化学方程式(有机物写结构简式,注明反应条件)
的化学方程式(有机物写结构简式,注明反应条件) .
.
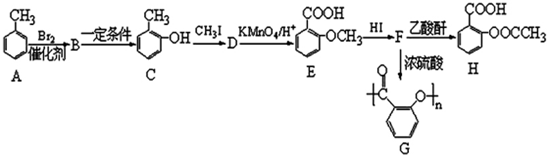
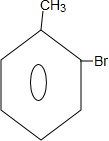 ;B→C的反应类型是取代反应.
;B→C的反应类型是取代反应.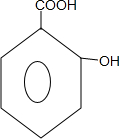 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$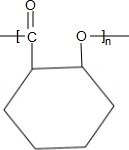 +nH2O.
+nH2O.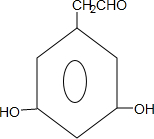 、
、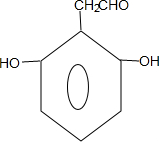 .
.