题目内容
2.下列化合物只含有离子键的是( )| A. | KCl | B. | Na2O2 | C. | KOH | D. | H2O |
分析 一般来说,活泼金属与非金属形成离子键,非金属之间形成共价键,以此来解答.
解答 解:A.KCl中只含离子键,故A选;
B.过氧化钠中含离子键和O-O共价键,故B不选;
C.KOH中含离子键和O-H共价键,故C不选;
D.水中含H-O共价键,故D不选;
故选A.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
10.类推思维是化学解题中常用的一种思维方法,下列有关离子方程式推理正确的是( )
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
| B | 向次氯酸钙溶液中通入二氧化碳气体 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向次氯酸钙溶液中通入二氧化硫气体 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C | 用惰性电极电解CuSO4溶液 2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H- | 用惰性电极电解CuCl2溶液 2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H- |
| D | 将少量CaCO3粉末投入足量盐酸中 CaCO3+2H+═Ca2++CO2↑+H2O | 将少量CaCO3粉末投入足量硝酸溶液中 CaCO3+2H+═Ca2++CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
17.下列说法正确的是( )
| A. | 共价化合物中不含离子键 | |
| B. | 凡是金属元素跟非金属元素化合形成离子化合物 | |
| C. | 离子化合物中的阳离子都是金属离子 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
7.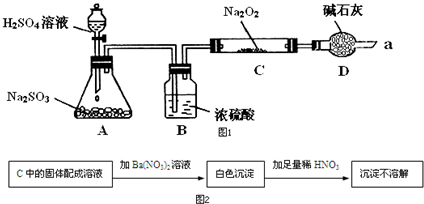 某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)
某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)
Ⅰ.装置B的作用是吸收水,干燥SO2气体,其原因是(用离子方程式表示)2Na2O2+2H2O=4Na++4OH-+O2↑.装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应.
Ⅱ.某同学想通过图2实验装置,检验反应中是否有O2生成时,其实验操作步骤是:
①先打开分液漏斗上口瓶塞和下口旋塞
②再用带火星的木条靠近干燥管口a,观察其是否复燃.
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3:有Na2SO3和Na2SO4.
(1)若假设2成立,写出所发生反应的化学方程式Na2O2+SO2=Na2SO4.
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如图2实验,C中的固体配成溶液加Ba(NO3)2溶液沉淀不溶解白色沉淀加足量稀HNO3.
得出结论:产物是Na2SO4.
该方案是否合理否 (填“是”或“否”).
(3)设计实验验证假设3的实验步骤如表:
若假设3成立,正确的实验操作顺序是③①②.
 某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)
某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)Ⅰ.装置B的作用是吸收水,干燥SO2气体,其原因是(用离子方程式表示)2Na2O2+2H2O=4Na++4OH-+O2↑.装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应.
Ⅱ.某同学想通过图2实验装置,检验反应中是否有O2生成时,其实验操作步骤是:
①先打开分液漏斗上口瓶塞和下口旋塞
②再用带火星的木条靠近干燥管口a,观察其是否复燃.
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3:有Na2SO3和Na2SO4.
(1)若假设2成立,写出所发生反应的化学方程式Na2O2+SO2=Na2SO4.
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如图2实验,C中的固体配成溶液加Ba(NO3)2溶液沉淀不溶解白色沉淀加足量稀HNO3.
得出结论:产物是Na2SO4.
该方案是否合理否 (填“是”或“否”).
(3)设计实验验证假设3的实验步骤如表:
| 实验步骤 | 实验现象 |
| ①滴加入过量的稀盐酸 | 产生剌激性气味气体 |
| ②滴加入适量的BaCl2溶液 | 产生白色沉淀. |
| ③取少量C中固体产物于试管中,加入适量的蒸馏水溶解 |
11.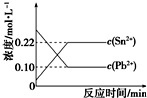 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断正确的是( )| A. | 25℃时,该反应的平衡常数K=2.2 | |
| B. | 往平衡体系中加入金属铅后,c(Pb2+)增大 | |
| C. | 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 | |
| D. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
12.NA代表阿伏加德罗常数,下列叙述正确的是( )
| A. | 1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子 | |
| B. | 1 mol O2在反应中得到电子数一定为4 NA | |
| C. | 1 mol Cl2在反应中得到电子数不一定为2NA | |
| D. | 在2KClO3+4HC1(浓)═2KCl+2C1O2↑+C12↑+2H2O中,氯气既是氧化产物又是还原产物,每生成1 mol Cl2转移2 NA 个电子 |