题目内容
15.按以下步骤可从 合成
合成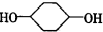 (部分试剂和反应条件已去).请回答下列问题:
(部分试剂和反应条件已去).请回答下列问题:
(1)反应①~⑦中属于消去反应的是②④(填代号).
(2)根据反应
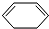 +Br$\stackrel{一定条件}{→}$
+Br$\stackrel{一定条件}{→}$ ,写出在同样条件下CH2=CH-CH=CH2与等物质的量Br发生加成反应的化学方程式:
,写出在同样条件下CH2=CH-CH=CH2与等物质的量Br发生加成反应的化学方程式: .
.(3)B、F的结构简式为:B
 F
F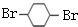 .
.(4)核磁共振谱是测定有机物分子结构最有用的工具之一.在有机物分子中,不同位置的氢原子在质子核磁共振谱(PMR)中给出的峰值(信号)也不同,根据峰(信号)可以确定有机物分子中氢原子的种类和数目.例如:乙醛的结构式为:
 ,其PMR谱中有2个信号峰,其强度之比为3:1.则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1:1:2的是BD.
,其PMR谱中有2个信号峰,其强度之比为3:1.则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1:1:2的是BD.A.
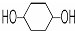 B.
B.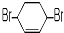 C.
C. D.
D.
(5)写出第④步
 的化学方程式(有机物写结构简式,注明反应条件)
的化学方程式(有机物写结构简式,注明反应条件) .
.
分析  与氢气发生加成反应生成A为
与氢气发生加成反应生成A为 ,A在浓硫酸、加热条件下发生消去反应生成B,则B为
,A在浓硫酸、加热条件下发生消去反应生成B,则B为 ,B与溴发生加成反应生成C为
,B与溴发生加成反应生成C为 ,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D(
,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D( ),D与溴发生1,4-加成生成E,E与氢气发生加成反应生成F,则F为
),D与溴发生1,4-加成生成E,E与氢气发生加成反应生成F,则F为 ,F在氢氧化钠水溶液、加热条件下发生水解反应生成G,G与草酸通过酯化反应发生的缩聚反应生成高聚物H,据此解答.
,F在氢氧化钠水溶液、加热条件下发生水解反应生成G,G与草酸通过酯化反应发生的缩聚反应生成高聚物H,据此解答.
解答 解: 与氢气发生加成反应生成A为
与氢气发生加成反应生成A为 ,A在浓硫酸、加热条件下发生消去反应生成B,则B为
,A在浓硫酸、加热条件下发生消去反应生成B,则B为 ,B与溴发生加成反应生成C为
,B与溴发生加成反应生成C为 ,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D(
,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D( ),D与溴发生1,4-加成生成E,E与氢气发生加成反应生成F,则F为
),D与溴发生1,4-加成生成E,E与氢气发生加成反应生成F,则F为 ,F在氢氧化钠水溶液、加热条件下发生水解反应生成G,G与草酸通过酯化反应发生的缩聚反应生成高聚物H,
,F在氢氧化钠水溶液、加热条件下发生水解反应生成G,G与草酸通过酯化反应发生的缩聚反应生成高聚物H,
(1)反应①~⑦中,①为加成反应,②为消去反应,③加成反应,④为消去反应,⑤为加成反应,⑥为加成反应,⑦为取代反应,故答案为:②④;
(2) 为1,4-加成反应,则CH2=CH-CH=CH2与等物质的量Br2发生1,4-加成反应的化学方程式为:
为1,4-加成反应,则CH2=CH-CH=CH2与等物质的量Br2发生1,4-加成反应的化学方程式为: ,
,
故答案为: ;
;
(3)由上述分析可知,B的结构简式为 ,F的结构简式为
,F的结构简式为 ,故答案为:
,故答案为: ;
; ;
;
(4)A.在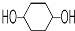 中核磁共振氢谱中能给出三种峰,且强度之比为1:1:4;
中核磁共振氢谱中能给出三种峰,且强度之比为1:1:4;
B.在 中核磁共振氢谱中能给出三种峰且强度之比为1:1:2;
中核磁共振氢谱中能给出三种峰且强度之比为1:1:2;
C.在 中核磁共振氢谱中能给出四种峰且强度之比为1:1:2:2;
中核磁共振氢谱中能给出四种峰且强度之比为1:1:2:2;
D. 中核磁共振氢谱中能给出3种峰且强度之比为1:1:2;
中核磁共振氢谱中能给出3种峰且强度之比为1:1:2;
故答案为:BD;
(5)第④步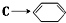 的化学方程式为
的化学方程式为 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的推断与合成,根据反应条件与有机物结构顺推进行推断,掌握官能团的性质是关键,难度中等.

练习册系列答案
相关题目
10.类推思维是化学解题中常用的一种思维方法,下列有关离子方程式推理正确的是( )
| 已知 | 类推 | |
| A | 将Fe加入CuSO4溶液中 Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中 2Na+Cu2+=Cu+2Na+ |
| B | 向次氯酸钙溶液中通入二氧化碳气体 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向次氯酸钙溶液中通入二氧化硫气体 Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C | 用惰性电极电解CuSO4溶液 2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H- | 用惰性电极电解CuCl2溶液 2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H- |
| D | 将少量CaCO3粉末投入足量盐酸中 CaCO3+2H+═Ca2++CO2↑+H2O | 将少量CaCO3粉末投入足量硝酸溶液中 CaCO3+2H+═Ca2++CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
20.下列各选项中两种粒子所含电子数不相等的是( )
| A. | 羟基(-OH)和氢氧根(OH-) | B. | 亚硝酸(HNO2)和亚硝酸根(NO2?) | ||
| C. | 硝基(-NO2)和二氧化氮(NO2) | D. | 羟甲基(-CH2OH)和甲氧基(CH3O-) |
7.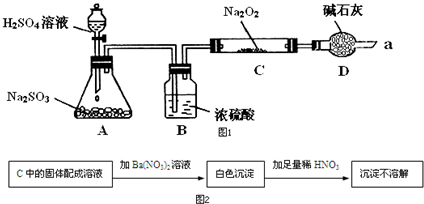 某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)
某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)
Ⅰ.装置B的作用是吸收水,干燥SO2气体,其原因是(用离子方程式表示)2Na2O2+2H2O=4Na++4OH-+O2↑.装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应.
Ⅱ.某同学想通过图2实验装置,检验反应中是否有O2生成时,其实验操作步骤是:
①先打开分液漏斗上口瓶塞和下口旋塞
②再用带火星的木条靠近干燥管口a,观察其是否复燃.
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3:有Na2SO3和Na2SO4.
(1)若假设2成立,写出所发生反应的化学方程式Na2O2+SO2=Na2SO4.
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如图2实验,C中的固体配成溶液加Ba(NO3)2溶液沉淀不溶解白色沉淀加足量稀HNO3.
得出结论:产物是Na2SO4.
该方案是否合理否 (填“是”或“否”).
(3)设计实验验证假设3的实验步骤如表:
若假设3成立,正确的实验操作顺序是③①②.
 某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)
某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)Ⅰ.装置B的作用是吸收水,干燥SO2气体,其原因是(用离子方程式表示)2Na2O2+2H2O=4Na++4OH-+O2↑.装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应.
Ⅱ.某同学想通过图2实验装置,检验反应中是否有O2生成时,其实验操作步骤是:
①先打开分液漏斗上口瓶塞和下口旋塞
②再用带火星的木条靠近干燥管口a,观察其是否复燃.
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3:有Na2SO3和Na2SO4.
(1)若假设2成立,写出所发生反应的化学方程式Na2O2+SO2=Na2SO4.
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如图2实验,C中的固体配成溶液加Ba(NO3)2溶液沉淀不溶解白色沉淀加足量稀HNO3.
得出结论:产物是Na2SO4.
该方案是否合理否 (填“是”或“否”).
(3)设计实验验证假设3的实验步骤如表:
| 实验步骤 | 实验现象 |
| ①滴加入过量的稀盐酸 | 产生剌激性气味气体 |
| ②滴加入适量的BaCl2溶液 | 产生白色沉淀. |
| ③取少量C中固体产物于试管中,加入适量的蒸馏水溶解 |
4.下列离子方程式书写正确的是( )
| A. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2 HCO3-═CaCO3↓+CO32-+2H2O | |
| B. | 向A1C13溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | Ba(OH)2溶液中滴入少量的NaHSO4溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | 向NH4HSO4稀溶液中逐滴加入Ba(OH)2稀溶液至刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3•H2O+H2O |
5.几种短周期元素的原子半径及某些化合价见下表,下列说法正确的是( )
| 元素代号 | A | B | C | D | E | F | G | H |
| 化合价 | -1 | -2 | +4、-4 | +7、-1 | +5、-3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | A的单质能从GD2溶液中置换出D单质 | |
| B. | G在CB2中燃烧生成两种化合物 | |
| C. | E元素的单质不存在同素异形体 | |
| D. | A、F、H的离子半径由大到小顺序是A>H>F |
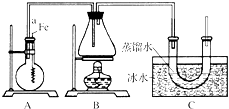 按如图所示的装置和以下实验步骤,可以制取少量的溴苯和溴乙烷.已知乙醇在一定条件下与氢溴酸反应可制备溴乙烷:
按如图所示的装置和以下实验步骤,可以制取少量的溴苯和溴乙烷.已知乙醇在一定条件下与氢溴酸反应可制备溴乙烷: