题目内容
18.一定量的质量分数为14%的KOH溶液,若将其蒸发掉100g水后,其质量分数为28%,体积为80mL,则浓缩后的KOH的物质的量浓度为( )| A. | 2.2 mol•L-1 | B. | 4 mol•L-1 | C. | 5 mol•L-1 | D. | 6.25 mol•L-1 |
分析 根据蒸发前后溶质的质量不变,计算出原溶液的质量,根据质量分数计算溶质的物质的量,进而计算溶液的物质的量浓度.
解答 解:设14%氢氧化钾溶液的质量为m,蒸发前后溶质的质量不变,则有m×14%=(m-100g)×28%,解得m=200g,
28%的氢氧化钾溶液中含有氢氧化钾的物质的量为$\frac{(200g-100g)×28%}{56g/mol}$=0.5mol,
所得溶液的物质的量浓度为$\frac{0.5mol}{0.08L}$=6.25mol/L,
故选:D.
点评 本题考查物质的量浓度的计算,难度不大,本题注意计算蒸发后溶液的质量为解答该题的关键.

练习册系列答案
相关题目
8.
(1)电离平衡常数是衡量弱电解质电离程度强弱的量.上表中给出几种弱电解质的电离平衡常数,从中可以判断:在相同温度下,同浓度的三种酸溶液的导电能力由大到小的顺序为CH3COOH>H2CO3>HCN.
(2)盐类水解程度的强弱同样与弱电解质的电离程度有一定联系,结合表中数据回答下列问题:
①25℃时,有等浓度的a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液,三种溶液的pH由大到小的顺序为b>a>c.(填溶液前序号)
②浓度相同的NaCN溶液与CH3COOK溶液相比,c(Na+)-c(CN-)>c(K+)-c(CH3COO-).(填“>”、“<”或“=”)
③将等体积等物质的量浓度的盐酸和氨水混合后,溶液呈酸性(填“酸”、“碱”或“中”),用离子方程式表示原因NH4++H2O?NH3•H2O+H+
④室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示.b点所示溶液中的溶质是NH3•H2O、NH4Cl
⑤NH4HCO3溶液呈碱性(填“酸”、“碱”或“中”)
(3)结合表中数据,向NaCN溶液中通入少量CO2,所发生反应的化学方程式NaCN+H2O+CO2=HCN+NaHCO3.

| 化学式 | NH3•H2O | HCN | CH3COOH | H2CO3 |
| 电离平衡常数(25℃) | Kb=1.77×10-5 | Ka=4.93×10-10 | Ka=1.76×10-5 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
(2)盐类水解程度的强弱同样与弱电解质的电离程度有一定联系,结合表中数据回答下列问题:
①25℃时,有等浓度的a.NaCN溶液、b.Na2CO3溶液、c.CH3COONa溶液,三种溶液的pH由大到小的顺序为b>a>c.(填溶液前序号)
②浓度相同的NaCN溶液与CH3COOK溶液相比,c(Na+)-c(CN-)>c(K+)-c(CH3COO-).(填“>”、“<”或“=”)
③将等体积等物质的量浓度的盐酸和氨水混合后,溶液呈酸性(填“酸”、“碱”或“中”),用离子方程式表示原因NH4++H2O?NH3•H2O+H+
④室温下,若将0.1mol•L-1盐酸滴入20mL 0.1mol•L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示.b点所示溶液中的溶质是NH3•H2O、NH4Cl
⑤NH4HCO3溶液呈碱性(填“酸”、“碱”或“中”)
(3)结合表中数据,向NaCN溶液中通入少量CO2,所发生反应的化学方程式NaCN+H2O+CO2=HCN+NaHCO3.
9.下列液体分别与碘水混合,充分振荡,静置后上层液体为紫红色,下层液体为无色的是( )
| A. | 四氯化碳 | B. | 酒精 | C. | 汽油 | D. | 氯化钠溶液 |
7.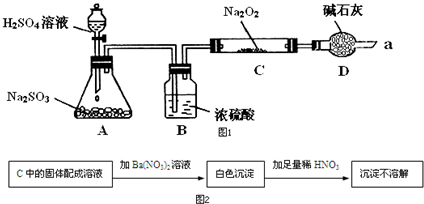 某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)
某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)
Ⅰ.装置B的作用是吸收水,干燥SO2气体,其原因是(用离子方程式表示)2Na2O2+2H2O=4Na++4OH-+O2↑.装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应.
Ⅱ.某同学想通过图2实验装置,检验反应中是否有O2生成时,其实验操作步骤是:
①先打开分液漏斗上口瓶塞和下口旋塞
②再用带火星的木条靠近干燥管口a,观察其是否复燃.
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3:有Na2SO3和Na2SO4.
(1)若假设2成立,写出所发生反应的化学方程式Na2O2+SO2=Na2SO4.
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如图2实验,C中的固体配成溶液加Ba(NO3)2溶液沉淀不溶解白色沉淀加足量稀HNO3.
得出结论:产物是Na2SO4.
该方案是否合理否 (填“是”或“否”).
(3)设计实验验证假设3的实验步骤如表:
若假设3成立,正确的实验操作顺序是③①②.
 某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)
某同学想通过如图装置实验、探究SO2与Na2O2反应的产物.(夹持装置已略去,装置的气密性良好)Ⅰ.装置B的作用是吸收水,干燥SO2气体,其原因是(用离子方程式表示)2Na2O2+2H2O=4Na++4OH-+O2↑.装置D除了吸收过量的SO2,避免污染空气外,还起到的作用是防止空气中的水蒸气和二氧化碳进入C装置与Na2O2反应.
Ⅱ.某同学想通过图2实验装置,检验反应中是否有O2生成时,其实验操作步骤是:
①先打开分液漏斗上口瓶塞和下口旋塞
②再用带火星的木条靠近干燥管口a,观察其是否复燃.
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3:有Na2SO3和Na2SO4.
(1)若假设2成立,写出所发生反应的化学方程式Na2O2+SO2=Na2SO4.
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲设计如图2实验,C中的固体配成溶液加Ba(NO3)2溶液沉淀不溶解白色沉淀加足量稀HNO3.
得出结论:产物是Na2SO4.
该方案是否合理否 (填“是”或“否”).
(3)设计实验验证假设3的实验步骤如表:
| 实验步骤 | 实验现象 |
| ①滴加入过量的稀盐酸 | 产生剌激性气味气体 |
| ②滴加入适量的BaCl2溶液 | 产生白色沉淀. |
| ③取少量C中固体产物于试管中,加入适量的蒸馏水溶解 |