题目内容
10.A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
①A、D溶液呈碱性,B呈酸性,C呈中性,
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失,
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝,
回答下列问题
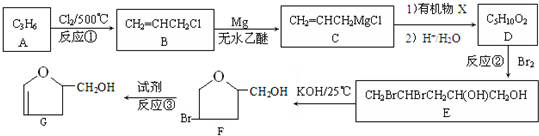
(1)A所含的阴离子的电子式是
 ,B所含的阳离子的结构示意图是
,B所含的阳离子的结构示意图是 ;
;(2)写出③中生成气体的离子方程式Ba2++CO32-+2NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+BaCO3↓;
(3)C的化学式是NaCl,
(4)简述D溶液呈碱性的理由NH4+的水解程度小于CO32-的水解程度.
分析 A、D溶液呈碱性,且A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝,则生成的气体为NH3,应是铵盐与碱的反应,由于NH4+离子不与OH-共存,NH4Cl、(NH4)2SO4溶液呈酸性,故A、D有一种为(NH4)2CO3,另外一种为Ba(OH)2或NaOH,B呈酸性,只能为AlCl3、Al2(SO4)3中的一种,而A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失,应是氢氧化钡与硫酸铝的反应,则A为Ba(OH)2,B为Al2(SO4)3,D为(NH4)2CO3,C为NaCl,据此解答.
解答 解:A、D溶液呈碱性,且A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝,则生成的气体为NH3,应是铵盐与碱的反应,由于NH4+离子不与OH-共存,NH4Cl、(NH4)2SO4溶液呈酸性,故A、D有一种为(NH4)2CO3,另外一种为Ba(OH)2或NaOH,B呈酸性,只能为AlCl3、Al2(SO4)3中的一种,而A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失,应是氢氧化钡与硫酸铝的反应,则A为Ba(OH)2,B为Al2(SO4)3,D为(NH4)2CO3,C为NaCl.
(1)A为Ba(OH)2,所含的阴离子的电子式是 ,B为Al2(SO4)3,所含的阳离子的结构示意图是
,B为Al2(SO4)3,所含的阳离子的结构示意图是 ,
,
故答案为: ;
; ;
;
(2)③中生成气体的反应为Ba(OH)2与(NH4)2CO3的反应,其离子反应为:Ba2++CO32-+2NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+BaCO3↓,
故答案为:Ba2++CO32-+2NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+BaCO3↓;
(3)由上述分析可知,C的化学式是:NaCl,故答案为:NaCl,
(4)D为(NH4)2CO3,其溶液显碱性,是因NH4+的水解程度小于CO32-的水解程度,故答案为:NH4+的水解程度小于CO32-的水解程度.
点评 本题考查物质的推断、离子的共存、盐类水解、常用化学用语等知识,较好的考查学生对知识的运用及分析推理能力,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 78 gNa2O2晶体中所含阴阳离子个数均为2NA | |
| B. | 1.5 g CH3+中含有的电子数为NA | |
| C. | 3.4 g氨气分子中含有0.6NA个N-H键 | |
| D. | 常温下,100 mL1 mol•L-1AlCl3溶液中Al3+离子总数等于0.1NA |
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O (g)的浓度随时间变化如图所示:

①写出该工业方法制取甲醇的化学反应方程式CO2+3H2?CH3OH+H2O.
②从反应开始到平衡,氢气的平均反应速率v (H2)=0.225mol•L-1•min-1.当温度降低时CO2的转化率变大,则该反应△H<0(填“>”“<”或“=”).
③下列措施中能使n(CH3OH)/n(CO2)增大的是C.
A.升高温度 B.充入氮气 C.将水蒸气从体系中分离 D.用更有效的催化剂
(2)选用合适的合金作为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极的电极方程式为CH3OH-6 e-+8OH-=CO32-+6H2O.
Ⅱ:已知下列物质在20℃下的Ksp如下,试回答下列问题:
| 化学式 | 颜色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 浅黄色 | 5.4×10-13 |
| AgI | 黄色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 红色 | 2.0×10-12 |
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(Βρ-)}{c(Χλ-)}$=2.7×10-3.
(3)测定水体中氯化物含量,常用标准硝酸银法进行滴定,滴定时应加入的指示剂_D.
A.KBr B.KI C.K2S D.K2CrO4.
| A. | 11和8 | B. | 12和17 | C. | 11和18 | D. | 8和12 |
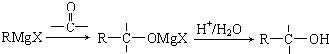
 (或
(或 );;
);;
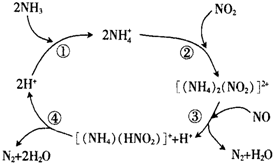 汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体.
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体.