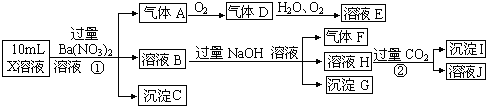
题目内容
2.(1)学生甲将a g过氧化钠投入100g水中,待固体全部消失后滴加两滴酚酞试液,观察到溶液先变红后褪色.用化学方程式表示变红的原因2Na2O2+2H2O=4NaOH+O2↑.该学生认为红色褪去的原因是Na2O2与水反应生成了H2O2,Na2O2消失后,未分解的H2O2将酚酞氧化漂白.(2)学生乙查到有关资料显示NaOH的浓度超过2mol/L时,也可使变红的酚酞随即褪色,为证明甲同学对褪色原因解释的合理性,实验时a不应超过7.8g(不考虑反应过程中溶液体积的变化)
(3)Na2O2不久能与H2O,也能与CO2反应,若Na2O2与CO2反应时,气体体积减小2.24L,反应中转移电子数目为0.2NA(气体体积均在标况下测定,阿伏加德罗常数用NA表示).
(4)在常温常压下有CO2和NO混合气体VL,用足量Na2O2固体缓慢、充分吸收后,总体积变为xL,x的取值范围是V>x≥$\frac{V}{2}$(不考虑N2O4的生成).
分析 (1)滴加两滴酚酞试液,观察到溶液先变红后褪色,说明Na2O2与水反应生成氢氧化钠成碱性遇酚酞变红;
(2)根据NaOH的浓度超过2mol/L时,也可使变红的酚酞随即褪色,为证明甲同学对褪色原因解释的合理性,所以溶液中的NaOH的浓度要小于2mol/L;
(3)反应2Na2O2+2CO2=2Na2CO3+O2中,只有O元素的化合价发生变化,Na2O2既是氧化剂又是还原剂,O元素化合价分别由-1价升高为0价、降低为-2价,则生成1molO2,转移2mol电子,结合反应的方程式计算;
(4)发生反应有:①2Na2O2+2CO2═2Na2CO3+O2,②2NO+O2═2NO2,方程式叠加可得2Na2O2+2NO+2CO2═2Na2CO3+2NO2,若CO2、NO按1:1恰好反应,则反应后气体体积为开始的一半,若CO2:NO>1:1,则发生2Na2O2+2CO2═2Na2CO3+O2,2Na2O2+2NO+2CO2═2Na2CO3+2NO2,则反应后气体体积仍为开始的一半,若CO2:NO<1:1,则发生2Na2O2+2NO+2CO2═2Na2CO3+2NO2,还有过量的NO,则反应后气体体积大于开始的一半,据此分析解答.
解答 解:(1)因为滴加两滴酚酞试液,观察到溶液先变红后褪色,说明Na2O2与水反应生成氢氧化钠成碱性遇酚酞变红,反应的方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(2)因为NaOH的浓度超过2mol/L时,也可使变红的酚酞随即褪色,所以为证明甲同学对褪色原因解释的合理性,则溶液中的NaOH的浓度要小于2mol/L,根据2Na2O2+2H2O=4NaOH+O2↑,过氧化钠的质量a不应超过2mol/L×0.1L×$\frac{1}{2}$×78g/mol=7.8g,故答案为:7.8g;
(3)反应2Na2O2+2CO2=2Na2CO3+O2中,只有O元素的化合价发生变化,Na2O2既是氧化剂又是还原剂,O元素化合价分别由-1价升高为0价、降低为-2价,则生成1molO2,转移2mol电子,由方程式2Na2O2+2CO2=2Na2CO3+O2可知,气体体积减小2.24L时,则生成氧气为2.24L即$\frac{2.24L}{22.4L/mol}$=0.1mol,使用反应中转移电子数目为0.2NA
,故答案为:0.2NA;
(4)在常温常压下有CO2和NO混合气体VL,用足量Na2O2固体缓慢、充分吸收后,发生反应有:①2Na2O2+2CO2═2Na2CO3+O2,②2NO+O2═2NO2,方程式叠加可得2Na2O2+2NO+2CO2═2Na2CO3+2NO2,
若CO2、NO按1:1恰好反应,则反应后气体体积为开始的一半,即x=$\frac{V}{2}$;
若CO2:NO>1:1,则发生2Na2O2+2CO2═2Na2CO3+O2,2Na2O2+2NO+2CO2═2Na2CO3+2NO2,则反应后气体体积仍为开始的一半,即x=$\frac{V}{2}$;
若CO2:NO<1:1,则发生2Na2O2+2NO+2CO2═2Na2CO3+2NO2,还有过量的NO,则反应后气体体积大于开始的一半,即V>x>$\frac{V}{2}$;
所以x的取值范围是V>x≥$\frac{V}{2}$;故答案为:V>x≥$\frac{V}{2}$.
点评 本题考查氧化还原反应以及混合物的有关计算,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意把握反应的化学方程式,关键是利用总反应方程式解答简化计算过程,注意差量法的应用,难度不大.

| A. | 1:9 | B. | 1:49 | C. | 1:99 | D. | 以上都不正确 |
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
①A、D溶液呈碱性,B呈酸性,C呈中性,
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失,
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝,
回答下列问题
(1)A所含的阴离子的电子式是
 ,B所含的阳离子的结构示意图是
,B所含的阳离子的结构示意图是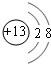 ;
;(2)写出③中生成气体的离子方程式Ba2++CO32-+2NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+BaCO3↓;
(3)C的化学式是NaCl,
(4)简述D溶液呈碱性的理由NH4+的水解程度小于CO32-的水解程度.
| A. | 使用的NaOH固体在空气中敞口放置了一段时间 | |
| B. | 容量瓶用蒸馏水洗净后,未经干燥 | |
| C. | 在烧杯中溶解NaOH后,未经冷却即将溶液转入容量瓶 | |
| D. | 调节天平零点时未将游码回到最左边 |
| 物质 | 粒子数目 | 质量(m)(g) | 物质的量(n)(mol) | 摩尔质量(M)(g/mol) |
| 氦气(He) | 0.2 | |||
| S | 1.204×1023 | |||
| CO2 | 22 | |||
| C12H12O11 | 0.25 |
| A. | 原电池是化学能转化成电能的装置 | |
| B. | 化学键断裂时吸收能量,形成时放出能量 | |
| C. | 化学反应中吸热反应时△H>0,放热反应时△H<0 | |
| D. | 标准状况下,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量为该物质的燃烧 |
| A. | 发酵粉中主要含有氢氧化钠,能使焙制出的糕点疏松多孔 | |
| B. | 碘盐中的碘可以直接用淀粉检验 | |
| C. | 碳酸氢钠可用于治疗胃酸过多 | |
| D. | 硫酸氢钠属于盐类,其水溶液显中性 |