题目内容
1.(1)下列有关实验操作的叙述,正确的是(填序号)CEA、用NaOH溶液除去乙酸乙酯中混有的乙酸、乙醇,然后分液
B、分馏石油时,温度计的末端必须插入液面下
C、用分液漏斗分离环己烷和水的混合液体
D、用氨水洗涤做过银镜反应的试管
E、配制银氨溶液时,将稀氨水逐滴加到稀硝酸银溶液中,至产生的沉淀刚好溶解
F、不慎将苯酚溶液沾到皮肤上,立即用氢氧化钠溶液清洗
(2)已知N2H5Cl是N2H4与HCl反应所得到的离子化合物,其水溶液与NH4Cl溶液一样呈酸性,请写出其水溶液呈酸性的原因(用离子方程式表示):N2H5++H2O?N2H4•H2O+H+.
若常温下将0.2mol/L HCl溶液与0.2mol/L N2H4•H2O溶液等体积混合(忽略混合后溶液体积的变化),若测得混合溶液的pH=6,则混合溶液中由水电离出的c(H+)> 0.1mol/LHCl溶液中由水电离出的c(H+) (填“>”、“<”、或“=”);
若常温下,若将0.2mol/L N2H4•H2O溶液与0.1mol/LHCl溶液等体积混合,测得混合溶液的pH>7,则说明在相同条件下N2H4•H2O的电离程度>N2H5Cl的水解程度 (填“>”、“<”、或“无法确定”).
(3)目前设计出能使液化石油气氧化直接产生电流的燃料电池是新世纪最富有挑战性的课题之一.最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入液化石油气(以C4H10表示),电池的电解质是掺入了Y2O3的ZrO2晶体,它在高温下传导O2-.
①已知该电池的负极反应为:$\frac{2}{13}$C4H10+2O2--e-$\frac{8}{13}$CO2+$\frac{10}{13}$H20,电池工作时,固体电解质里的O2-向负极移动.
②液化石油气电池最大的障碍是氧化还原反应不完全而产生的固体碳(或炭粒)(填写物质的名称)堵塞电极的气体通道.
分析 (1)A、NaOH溶液与乙酸乙酯、乙酸都反应;
B、分馏石油时,温度计用于测量馏分的温度;
C、环己烷和水互不相溶;
D、氨水与银不反应;
E、配制银氨溶液应将稀氨水逐滴加到稀硝酸银溶液中;
F、氢氧化钠具有腐蚀性;
(2)N2H5Cl水溶液呈酸性,为强酸弱碱盐,若常温下将0.2mol/L HCl溶液与0.2mol/L N2H4•H2O溶液等体积混合(忽略混合后溶液体积的变化),二者恰好反应生成N2H5Cl,若测得混合溶液的pH=6,说明N2H5Cl水解,则促进水的电离,
若将0.2mol/L N2H4•H2O溶液与0.1mol/LHCl溶液等体积混合,所得溶液为N2H5Cl和N2H4•H2O的混合物,测得混合溶液的pH>7,则说明在相同条件下N2H4•H2O的电离程度大于N2H5Cl水解程度;
(3)①燃料电池中,电池的正极反应式为燃料电池的总反应减去负极反应式,电解质溶液中阴离子向负极移动;
②丁烷不完全氧化会生成碳粒,从而堵塞电极的气体通道
解答 解:(1)A、NaOH溶液与乙酸乙酯、乙酸都反应,应用饱和碳酸钠溶液除杂,故A错误;
B、分馏石油时,温度计用于测量馏分的温度,应位于蒸馏烧瓶的支管口附近,故B错误;
C、环己烷和水互不相溶,可用分液漏斗分离,故C正确;
D、氨水与银不反应,应用稀硝酸洗涤做过银镜反应的试管,故D错误;
E、配制银氨溶液时,将稀氨水逐滴加到稀硝酸银溶液中,至产生的沉淀刚好溶解时,恰好生成银氨溶液,故E正确;
F、氢氧化钠具有腐蚀性,不慎将苯酚溶液沾到皮肤上,立即用酒精溶液清洗,故F错误.
故答案为:CE;
(2)N2H5Cl水溶液呈酸性,为强酸弱碱盐,水解的离子方程式为N2H5++H2O?N2H4•H2O+H+,若常温下将0.2mol/L HCl溶液与0.2mol/L N2H4•H2O溶液等体积混合(忽略混合后溶液体积的变化),二者恰好反应生成N2H5Cl,若测得混合溶液的pH=6,说明N2H5Cl水解,则促进水的电离,
若将0.2mol/L N2H4•H2O溶液与0.1mol/LHCl溶液等体积混合,所得溶液为N2H5Cl和N2H4•H2O的混合物,测得混合溶液的pH>7,则说明在相同条件下N2H4•H2O的电离程度大于N2H5Cl水解程度,
故答案为:N2H5++H2O?N2H4•H2O+H+;>;>;
(3)①燃料电池的总反应和燃料燃烧的化学方程式一致,电池总反应为$\frac{2}{13}$C4H10+2O2--e-$\frac{8}{13}$CO2+$\frac{10}{13}$H20,O2在正极应该得到电子,总反应减负极反应可得正极反应式,为O2+4e-=2O2-;正极生成O2-,负极消耗O2-,O2-向负极移动,故答案为:负;
②烷不完全氧化会生成碳粒,从而堵塞电极的气体通道,故答案为:固体碳(或炭粒).
点评 本题考查较为综合,涉及化学实验方案的评价,盐类的水解以及原电池知识,为高考常见题型和高频考点,侧重于学生的分析能力、实验能力的考查,注意相关基础知识的积累,难度中等.

| A. | 25℃时pH=10的NaOH溶液与pH=10的氨水中:c(Na+)>c(NH${\;}_{4}^{+}$) | |
| B. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH) | |
| C. | 在NaHA溶液中(H2A为弱酸):c(Na+)>c(HA-)>c(OH-)>c(H+) | |
| D. | 室温下,向0.01 mol•L-1 NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(OH-)=c(H+) |
| A. | 氢氧化钠用于治疗胃溃疡病人的胃酸过多症 | |
| B. | 在AlCl3溶液中加入过量氨水最终无沉淀生成 | |
| C. | 工业上可利用钠和TiCl4溶液反应制取金属Ti | |
| D. | 锅炉中水垢可用盐酸或醋酸除去 |
| A. | 1:9 | B. | 1:49 | C. | 1:99 | D. | 以上都不正确 |
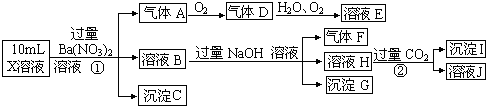
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
①A、D溶液呈碱性,B呈酸性,C呈中性,
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失,
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝,
回答下列问题
(1)A所含的阴离子的电子式是
 ,B所含的阳离子的结构示意图是
,B所含的阳离子的结构示意图是 ;
;(2)写出③中生成气体的离子方程式Ba2++CO32-+2NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+BaCO3↓;
(3)C的化学式是NaCl,
(4)简述D溶液呈碱性的理由NH4+的水解程度小于CO32-的水解程度.
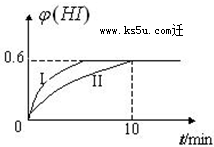 将1mol I2(g) 和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,2min时,测得I2的物质的量为0.6mol.10min后达到平衡,HI的体积分数φ(H)随时间变化如下图中曲线II所示.
将1mol I2(g) 和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,2min时,测得I2的物质的量为0.6mol.10min后达到平衡,HI的体积分数φ(H)随时间变化如下图中曲线II所示.