题目内容
2. 汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体.
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体.(1)当空燃比(空气与燃油气的体积比)不同时,汽车尾气的主要成分不同.空燃比较小时的有毒气体主要是CO(填化学式).
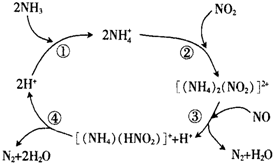
(2)某分子筛类催化剂(H+交换沸石)催化NH3脱除NO、NO2的反应机理如图所示.
步骤③转化反应的离子方程式是[(NH4)2(NO2)]2++NO=N2+H2O+[(NH4)(HNO2)]++H+.按如图反应机理,NH3脱除NO、NO2总反应的化学方程式是NO+NO2+2NH3$\frac{\underline{\;H+\;}}{\;}$2N2+3H2O.
(3)NaClO2溶液将NO转化为HNO3的反应历程如下:
NaClO2+HCl=HClO2+NaCl
8HClO2═6ClO2↑+Cl2↑+4H2O
2NaClO2+Cl2═2NaCl+2ClO2↑
5NO+3ClO2+4H2O═5HNO3+3HCl
则酸性条件下NaClO2溶液将NO转化为HNO3的总反应的化学方程式为3NaClO2+4NO+2H2O═4HNO3+3NaCl.
分析 (1)空/燃比较小时,燃料不能充分燃烧,则生成CO;
(2)根据图示可知:步骤③反应物为[(NH4)2(NO2)]2+、NO,生成物为N2、H2O、[(NH4)(HNO2)]+、H+,根据原子守恒电荷守恒书写,根据反应①②③④分析可得NH3脱除NO、NO2总反应;
(3)根据题干信息可知反应物为:NaClO2、NO,生成物为:HNO3,结合已知反应方程式进行书写.
解答 解:(1)当空/燃比较小时,汽油中的碳发生不完全燃烧产生一氧化碳,有毒,
故答案为:CO;
(2)根据图示各步反应为:步骤①:NH3+H+=NH4+,步骤②:2NH4++NO2=[(NH4)2(NO2)]2+,步骤③:[(NH4)2(NO2)]2++NO=N2+H2O+[(NH4)(HNO2)]++H+,步骤④:[(NH4)(HNO2)]+=N2+2H2O+H+,①+②+③+④得:NO+NO2+2NH3$\frac{\underline{\;H+\;}}{\;}$2N2+3H2O,所以NH3脱除NO、NO2总反应的化学方程式为:NO+NO2+2NH3$\frac{\underline{\;H+\;}}{\;}$2N2+3H2O,
故答案为:[(NH4)2(NO2)]2++NO=N2+H2O+[(NH4)(HNO2)]++H+;NO+NO2+2NH3$\frac{\underline{\;H+\;}}{\;}$2N2+3H2O;
(3)①NaClO2+HCl=HClO2+NaCl②8HClO2═6ClO2↑+Cl2↑+4H2O③2NaClO2+Cl2═2NaCl+2ClO2↑④5NO+3ClO2+4H2O═5HNO3+3HCl
将$\frac{[①×8+②+③]×3+④×8}{10}$ 得酸性条件下NaClO2溶液将NO转化为HNO3的总反应的化学方程式:3NaClO2+4NO+2H2O═4HNO3+3NaCl,
故答案为:3NaClO2+4NO+2H2O═4HNO3+3NaCl.
点评 本题主要考查了汽车尾气处理,读懂图示以及根据反应物和生成物进行正确书写方程式是解答的关键,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
①A、D溶液呈碱性,B呈酸性,C呈中性,
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失,
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝,
回答下列问题
(1)A所含的阴离子的电子式是
 ,B所含的阳离子的结构示意图是
,B所含的阳离子的结构示意图是 ;
;(2)写出③中生成气体的离子方程式Ba2++CO32-+2NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+BaCO3↓;
(3)C的化学式是NaCl,
(4)简述D溶液呈碱性的理由NH4+的水解程度小于CO32-的水解程度.

已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(2)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(3)“操作I”的主要操作为蒸发浓缩、冷却结晶、过滤洗涤.
(4)写出加入NaClO时,溶液中氧化还原反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(5)已知:溶液的pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式[Al(OH)]2++H+=[Al(OH)]++H2O.
(6)某同学为探究Ag+和Fe2+反应,按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为负极(填“正”或“负”).由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.

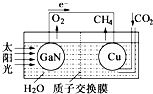 科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以
科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.以下说法错误的是( )
| A. | 铜电极表面的电极反应式 CO2+8e-+8H+=CH4+2H2O | |
| B. | 为提高该人工光合系统的工作效率,可向装置中加入少量硫酸 | |
| C. | 该装置仅将化学能转变为电能 | |
| D. | 装置中的H+由左向右移动 |
| A. | 凡是含有离子键的化合物一定是离子化合物 | |
| B. | 含有共价键的化合物都是共价化合物 | |
| C. | 凡是能电离出离子的化合物都是离子化合物 | |
| D. | 非金属原子间以共价键结合的物质都是共价化合物 |
| A. | 发酵粉中主要含有氢氧化钠,能使焙制出的糕点疏松多孔 | |
| B. | 碘盐中的碘可以直接用淀粉检验 | |
| C. | 碳酸氢钠可用于治疗胃酸过多 | |
| D. | 硫酸氢钠属于盐类,其水溶液显中性 |
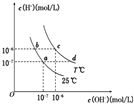 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )| A. | a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3- | |
| C. | c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+ | |
| D. | d点对应的溶液中大量存在:Na+、K+、ClO-、Cl- |
| A. | 应用高效洁净的能源转换技术,推广使用节能环保材料 | |
| B. | 大力发展火力发电,解决电力紧张问题 | |
| C. | 研发以高纯硅为核心材料的光伏发电技术 | |
| D. | 大力开发新能源,如核能、太阳能、风能等,减少化石能源的使用 |