题目内容
19.A、B两种元素能形成A2B2型化合物,则A和B的原子序数可能是( )| A. | 11和8 | B. | 12和17 | C. | 11和18 | D. | 8和12 |
分析 根据选项中原子序数确定具体的元素,再结合元素形成常见化合物判断.
解答 解:A.11、8号元素分别是Na、O元素,二者形成共价化合物Na2O2、Na2O,故A正确;
B.12、17号元素分别是Mg、Cl元素,能形成离子化合物MgCl2,不符合A2B2型化合物,故B错误;
C.11、18号元素分别是Na、Ar元素,Ar不易形成化合物,故C错误;
D.8、12号元素分别是O、Mg元素,二者形成MgO,不符合A2B2型化合物,故D错误;
故选A.
点评 本题考查原子结构和元素性质,熟练掌握原子结构与元素周期表结构,注意利用类推法解答,难度不大.

练习册系列答案
相关题目
10.A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
分别取四种物质进行实验,实验结果如下
①A、D溶液呈碱性,B呈酸性,C呈中性,
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失,
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝,
回答下列问题
(1)A所含的阴离子的电子式是 ,B所含的阳离子的结构示意图是
,B所含的阳离子的结构示意图是 ;
;
(2)写出③中生成气体的离子方程式Ba2++CO32-+2NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+BaCO3↓;
(3)C的化学式是NaCl,
(4)简述D溶液呈碱性的理由NH4+的水解程度小于CO32-的水解程度.
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
①A、D溶液呈碱性,B呈酸性,C呈中性,
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失,
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝,
回答下列问题
(1)A所含的阴离子的电子式是
 ,B所含的阳离子的结构示意图是
,B所含的阳离子的结构示意图是 ;
;(2)写出③中生成气体的离子方程式Ba2++CO32-+2NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+BaCO3↓;
(3)C的化学式是NaCl,
(4)简述D溶液呈碱性的理由NH4+的水解程度小于CO32-的水解程度.
7.补充表格:
| 物质 | 粒子数目 | 质量(m)(g) | 物质的量(n)(mol) | 摩尔质量(M)(g/mol) |
| 氦气(He) | 0.2 | |||
| S | 1.204×1023 | |||
| CO2 | 22 | |||
| C12H12O11 | 0.25 |
14.下列说法不正确的是( )
| A. | 原电池是化学能转化成电能的装置 | |
| B. | 化学键断裂时吸收能量,形成时放出能量 | |
| C. | 化学反应中吸热反应时△H>0,放热反应时△H<0 | |
| D. | 标准状况下,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量为该物质的燃烧 |
4.下列说法正确的是( )
| A. | 3.0g C2H6的中含有公用电子对的数目为0.7×6.02×1023 | |
| B. | 25℃时,pH=1的醋酸中H+含有的数目为0.1×6.02×1023 | |
| C. | 已知2CO(g)+O2(g)?2CO2(g)△H=+-a kJ•mol-1,将2 NA 个CO与 NA 个O2混合,充分反应放出a kJ的热量 | |
| D. | 50mL 18.4mol•L-1 浓硫酸与足量铜微热反应生成 SO2分子数目为0.46NA |
10.硼镁泥是一种工业废料,主要成分是MgO,还有CaO、MnO、Fe2O、FeO、Al2O3,、SiO2等杂质,以此为原料制取的硫酸镁可用于印染、造纸、医药等工业.从硼镁泥中制取MgSO4•7H2O的工艺流程如下:

已知:NaClO与Mn2+反应产生MnO2沉淀.
(1)实验中需用1.00mol•L-1的硫酸80.0ml.若用98%的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有烧杯、100mL容量瓶.
(2)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(3)“操作I”的主要操作为蒸发浓缩、冷却结晶、过滤洗涤.
(4)写出加入NaClO时,溶液中氧化还原反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(5)已知:溶液的pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式[Al(OH)]2++H+=[Al(OH)]++H2O.
(6)某同学为探究Ag+和Fe2+反应,按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为负极(填“正”或“负”).由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.


已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(2)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(3)“操作I”的主要操作为蒸发浓缩、冷却结晶、过滤洗涤.
(4)写出加入NaClO时,溶液中氧化还原反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(5)已知:溶液的pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式[Al(OH)]2++H+=[Al(OH)]++H2O.
(6)某同学为探究Ag+和Fe2+反应,按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为负极(填“正”或“负”).由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.

11.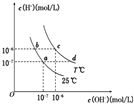 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )| A. | a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3- | |
| C. | c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+ | |
| D. | d点对应的溶液中大量存在:Na+、K+、ClO-、Cl- |
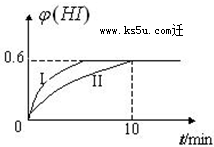 将1mol I2(g) 和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,2min时,测得I2的物质的量为0.6mol.10min后达到平衡,HI的体积分数φ(H)随时间变化如下图中曲线II所示.
将1mol I2(g) 和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,2min时,测得I2的物质的量为0.6mol.10min后达到平衡,HI的体积分数φ(H)随时间变化如下图中曲线II所示.