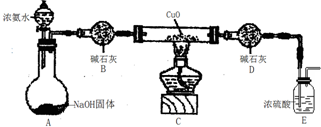
题目内容
18.有机物G是某种新型药物的中间体,其合成路线如下: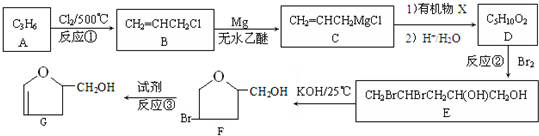
已知:
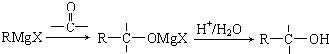
回答下列问题:
(1)B的化学名称为3-氯丙烯;
(2)反应①的反应类型是取代反应;写出反应③所需要的试剂氢氧化钠的醇溶液;
(3)写出有机物X的结构简式HOCH2CHO;
(4)写出由E到F的化学方程式
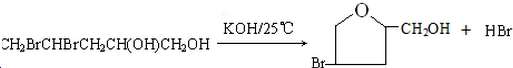 (或
(或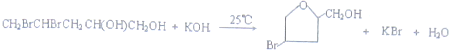 );;
);;(5)D的同分异构体中,即能发生银镜反应,又能发生水解反应的共有4种,其中核磁共振氢谱为2组峰,且峰面积比为9:1的为:HCOOC(CH3)3(写结构简式)
(6)以1-丙醇为原料可合成丙三醇,请设计合成路线(无机试剂及溶剂任选).
注:合成路线的书写格式参照如下示例流程图:CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH$→_{浓硫酸}^{CH_{3}CH_{2}OH}$CH3COOCH2CH3.
分析 A与氯气反应生成B(CH2=CHCH2Cl),该反应为取代反应,则A的结构简式为:CH2=CHCH3;B与Mg在无水乙醚条件下反应生成C(CH2=CHCH2MgCl),D与Br2发生加成反应生成E,则D的结构简式为CH2=CHCH2CH(OH)CH2OHCl,结合题干反应原理可知,有机物X为HOCH2CHO;有机物E发生反应: 生成F,根据G可知,反应③为卤代烃的消去反应,反应条件为氢氧化钠的醇溶液,根据以上分析解答(1)~(4);
生成F,根据G可知,反应③为卤代烃的消去反应,反应条件为氢氧化钠的醇溶液,根据以上分析解答(1)~(4);
(5)根据D的结构简式及题中限制条件书写出满足条件的有机物的结构简式;
(6)以1-丙醇为原料合成丙三醇,目标产物中含有3个羟基,需要通过消去反应、加成反应CH2ClCHClCH2Cl,然后通过水解反应生成丙三醇,据此设计合成流程.
解答 解:A与氯气反应生成B(CH2=CHCH2Cl),该反应为取代反应,则A的结构简式为:CH2=CHCH3;B与Mg在无水乙醚条件下反应生成C(CH2=CHCH2MgCl),D与Br2发生加成反应生成E,则D的结构简式为CH2=CHCH2CH(OH)CH2OHCl,结合题干反应原理可知,有机物X为HOCH2CHO;有机物E发生反应: 生成F,根据G可知,反应③为卤代烃的消去反应,反应条件为氢氧化钠的醇溶液,
生成F,根据G可知,反应③为卤代烃的消去反应,反应条件为氢氧化钠的醇溶液,
(1)根据B的结构简式可知其名称为3-氯丙烯,
故答案为:3-氯丙烯;
(2)根据分析可知,反应①为取代反应,反应③为卤代烃的消去反应,反应条件为氢氧化钠的醇溶液;
故答案为:取代反应;氢氧化钠的醇溶液;
(3)由分析可知,有机物X的结构简式为HOCH2CHO,
故答案为:HOCH2CHO;
(4)由E到F的化学方程式为: 或
或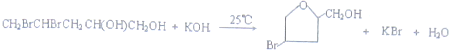 ,
,
故答案为: (或
(或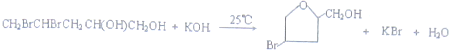 );
);
(5)D的结构简式为CH2=CHCH2CH(OH)CH2OHCl,①能发生银镜反应,其分子中含有醛基;②能发生水解反应,分子中含有酯基,则满足以上条件的有机物的结构简式有HCOOCH2CH2CH2CH3、HCOOCH(CH3)CH2CH3、HCOOCH2CH(CH3)2、HCOOC(CH3)3,共4种,其中核磁共振氢谱为2组峰,且峰面积比为9:1的为HCOOC(CH3)3,
故答案为:4;HCOOC(CH3)3;
(6)以1-丙醇为原料合成丙三醇,应该先使丙醇发生消去反应生成丙烯,然后丙烯与氯气在500℃条件下发生取代反应生成CH2=CHCH2Cl,CH2=CHCH2Cl与氯气发生加成反应生成CH2ClCHClCH2Cl,CH2ClCHClCH2Cl在氢氧化钠的水溶液中发生取代反应生成丙三醇,所以制备流程为:CH3CH2CH2OH$→_{△}^{浓硫酸}$CH2=CHCH3$→_{500℃}^{Cl_{2}}$CH2=CHCH2Cl$\stackrel{Cl_{2}}{→}$CH2ClCHClCH2Cl$→_{△}^{NaOH/H_{2}O}$CH2OHCH(OH)CH2OH,
故答案为:CH3CH2CH2OH$→_{△}^{浓硫酸}$CH2=CHCH3$→_{500℃}^{Cl_{2}}$CH2=CHCH2Cl$\stackrel{Cl_{2}}{→}$CH2ClCHClCH2Cl$→_{△}^{NaOH/H_{2}O}$CH2OHCH(OH)CH2OH.
点评 本题考查有机合成,题目难度中等,明确合成流程及反应原理为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力,注意掌握常见有机物结构与性质,能够正确设计出位置制备流程.

| A. | 0.2mol Na+ | B. | 0.05mol CO${\;}_{3}^{2-}$ | ||
| C. | 6.02×1023个O | D. | 0.1mol H |
| A. | 氢氧化钠用于治疗胃溃疡病人的胃酸过多症 | |
| B. | 在AlCl3溶液中加入过量氨水最终无沉淀生成 | |
| C. | 工业上可利用钠和TiCl4溶液反应制取金属Ti | |
| D. | 锅炉中水垢可用盐酸或醋酸除去 |
| A. | 1:9 | B. | 1:49 | C. | 1:99 | D. | 以上都不正确 |
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
①A、D溶液呈碱性,B呈酸性,C呈中性,
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失,
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝,
回答下列问题
(1)A所含的阴离子的电子式是
 ,B所含的阳离子的结构示意图是
,B所含的阳离子的结构示意图是 ;
;(2)写出③中生成气体的离子方程式Ba2++CO32-+2NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+BaCO3↓;
(3)C的化学式是NaCl,
(4)简述D溶液呈碱性的理由NH4+的水解程度小于CO32-的水解程度.
| 物质 | 粒子数目 | 质量(m)(g) | 物质的量(n)(mol) | 摩尔质量(M)(g/mol) |
| 氦气(He) | 0.2 | |||
| S | 1.204×1023 | |||
| CO2 | 22 | |||
| C12H12O11 | 0.25 |

已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(2)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还有MnO2、SiO2.
(3)“操作I”的主要操作为蒸发浓缩、冷却结晶、过滤洗涤.
(4)写出加入NaClO时,溶液中氧化还原反应的离子方程式Mn2++ClO-+H2O=MnO2↓+2H++Cl-、2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(5)已知:溶液的pH>3时,铝元素有多种存在形态,如A13+、[Al(OH)]2+、[Al(OH)2]+等,各形态之间可相互转化,写出该溶液中[Al(OH)]2+转化为[Al(OH)2]+的离子方程式[Al(OH)]2++H+=[Al(OH)]++H2O.
(6)某同学为探究Ag+和Fe2+反应,按如图连接装置并加入药品(盐桥中的物质不参与反应),发现电压表指针偏移.电子由石墨经导线流向银.放置一段时间后,向甲烧杯中逐渐加入浓Fe2(SO4)3溶液,发现电压表指针的变化依次为:偏移减小-回到零点-逆向偏移.则电压表指针逆向偏移后,银为负极(填“正”或“负”).由实验得出Ag+和Fe2+反应的离子方程式是Fe2++Ag+?Fe3++Ag.

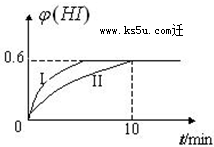 将1mol I2(g) 和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,2min时,测得I2的物质的量为0.6mol.10min后达到平衡,HI的体积分数φ(H)随时间变化如下图中曲线II所示.
将1mol I2(g) 和2mol H2(g)置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,2min时,测得I2的物质的量为0.6mol.10min后达到平衡,HI的体积分数φ(H)随时间变化如下图中曲线II所示.