题目内容
5.Ⅰ.2011年11月28日至12月9日,联合国气候变化框架公约第17次缔约方会议在南非德班召开,随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3.25mol H2,在一定条件下发生反应,测定CO2、CH3OH(g)和H2O (g)的浓度随时间变化如图所示:

①写出该工业方法制取甲醇的化学反应方程式CO2+3H2?CH3OH+H2O.
②从反应开始到平衡,氢气的平均反应速率v (H2)=0.225mol•L-1•min-1.当温度降低时CO2的转化率变大,则该反应△H<0(填“>”“<”或“=”).
③下列措施中能使n(CH3OH)/n(CO2)增大的是C.
A.升高温度 B.充入氮气 C.将水蒸气从体系中分离 D.用更有效的催化剂
(2)选用合适的合金作为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此燃料电池负极的电极方程式为CH3OH-6 e-+8OH-=CO32-+6H2O.
Ⅱ:已知下列物质在20℃下的Ksp如下,试回答下列问题:
| 化学式 | 颜色 | Ksp |
| AgCl | 白色 | 2.0×10-10 |
| AgBr | 浅黄色 | 5.4×10-13 |
| AgI | 黄色 | 8.3×10-17 |
| Ag2S | 黑色 | 2.0×10-48 |
| Ag2CrO4 | 红色 | 2.0×10-12 |
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,$\frac{c(Βρ-)}{c(Χλ-)}$=2.7×10-3.
(3)测定水体中氯化物含量,常用标准硝酸银法进行滴定,滴定时应加入的指示剂_D.
A.KBr B.KI C.K2S D.K2CrO4.
分析 Ⅰ.(1)①根据题目内容可知,该工业方法制取甲醇为二氧化碳与氢气反应生成甲醇和水;
②根据三段式计算出反应混合物各组分的浓度变化量、平衡时的浓度,根据v=$\frac{△c}{△t}$计算出v(H2);
③根据转化率的定义计算平衡时二氧化碳的转化率;当温度降低时K值变大,说明平衡向正反应进行,温度降低平衡向放热反应进行;
④使n(CH3OH)/n(CO2)增大应使平衡向正反应方向移动分析;
(2)甲醇为原料的燃料电池中,燃料甲醇为负极,发生失电子的氧化反应,碱性条件下生成CO32-;
Ⅱ.(1)①依据溶度积常数计算银离子浓度比较判断;
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时依据氯化银和溴化银的溶度积可知,氯化银溶解度大于溴化银,依据氯化银和溴化银的溶度积计算和沉淀转化关系计算得到;
(3)测定水体中氯化物的含量,必须使氯离子完全生成白色沉淀,指示沉淀反应完全的试剂溶解性一定小于氯化银,所以本题应在Ag+和Cl-生成AgCl沉淀后,再生成不同颜色沉淀指示沉淀终点.则指示剂的溶解度应比AgCl大来分析判断.
解答 解:(1)①该工业方法制取甲醇原理为二氧化碳与氢气反应生成甲醇和水,反应方程式为CO2(g)+3H2(g) CH3OH(g)+H2O(g),
CH3OH(g)+H2O(g),
故答案为:CO2(g)+3H2(g) CH3OH(g)+H2O(g);
CH3OH(g)+H2O(g);
②根据三段式计算CO2(g)+3 H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
开始(mol/L):1 3.25 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 1 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=$\frac{2.25mol/L}{10min}$=0.225mol/(L.min),
故答案为:0.225mol/(L.min);
③平衡时二氧化碳的转化率为$\frac{0.75mol/L}{1mol/L}$×100%=75%,当温度降低时K值变大,说明平衡向正反应进行,温度降低平衡向吸放热反应进行,即正反应为放热反应,△H<0,
故答案为:75%;<;
④使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.该反应正反应为放热反应,则升高温度平衡向逆反应方向移动,n(CH3OH)/n(CO2)减小,故A错误;
B.充入N2气,参加反应的物质的浓度不变,平衡不移动,故B错误;
C.将H2O(g)从体系中分离,生成物浓度减小,平衡向正反应方向移动,故C正确;
D.用更有效的催化剂,平衡不移动,故D错误.
故答案为:C;
(2)甲醇为原料的燃料电池中,燃料甲醇为负极,发生失电子的氧化反应,碱性条件下生成CO32-,其电极反应式为CH3OH-6 e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O.
Ⅱ.(1)20℃时,上述三种银盐饱和溶液中,Ag+物质的量浓度可以计算得到:①Ksp(AgCl)=c(Ag+)×c(Cl-)=2.0×10-10,c(Ag+)=$\sqrt{2.0×1{0}^{-10}}$;②Ksp(AgBr)=c(Ag+)×c(Br-)=5.4×10-13,c(Ag+)=$\sqrt{5.4×1{0}^{-13}}$;③Ksp(AgI)=c(Ag+)×c(I-)=8.3×10-17 ,c(Ag+)=$\sqrt{8.3×1{0}^{-17}}$;Ksp(Ag2S)=c(Ag+)2×c(Br-)=2.0×10-48,c(Ag+)=$\root{3}{2.0×1{0}^{-48}}$;Ksp(Ag2CrO4)=c(Ag+)2×c(CrO42-)4=2.0×10-12,c(Ag+)=$\root{3}{2.0×1{0}^{-6}}$,
所以三种银盐的饱和溶液中,Ag+物质的量浓度由大到小的顺序是:Ag2CrO4>AgCl>AgBr>AgI>Ag2S,故答案为:Ag2CrO4>AgCl>AgBr>AgI>Ag2S;
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,依据溶度积常数判断AgBr的溶解度小于AgCl溶解度,AgCl+Br-=AgBr+Cl-;Ksp=c(Ag+)×c(Cl-),Ksp=c(Ag+)×c(Br-),所以$\frac{c(B{r}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgBr)}{Ksp(AgCl)}$=$\frac{5.4×1{0}^{-13}}{2.0×1{0}^{-10}}$=2.7×10-3,
故答案为:2.7×10-3;
(3)A、氯化银、溴化银、碘化银的组成都是1:1,依据Ksp可以直接比较溶解性大小为氯化银>溴化银>碘化银;随Ksp的减小,应先出现碘化银沉淀、再出现溴化银,最后才沉淀氯化银;所以不符合滴定实验的目的和作用,不能测定氯化物的含量,故A不选;
B、依据A分析可知碘化银优先于氯化银析出,不能测定氯化物的含量,故B不选;
C、硫化银的Ksp很小,Ksp=[Ag+]2[S2-]=1.3×10-16,计算得到需要的银离子浓度c(S2-)=$\root{3}{\frac{1.3×1{0}^{-16}}{2}}$=$\root{3}{6.5×1{0}^{-17}}$;Ksp(AgCl)=[Ag+][Cl-]=1.5×10-4,[Cl-]=$\sqrt{1.5×1{0}^{-4}}$,通过计算得出硫化银也比氯化银先沉淀.故C不选;
D、铬酸银的阳、阴离子个数比为2:1,可以计算相同浓度的银离子沉淀氯离子、铬酸根离子需要的浓度,依据Ksp计算得到,Ksp(AgCl)=[Ag+][Cl-]=1.5×10-4,Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=4.3×10-2;[Cl-]=$\sqrt{1.5×1{0}^{-4}}$;[CrO42-]=$\sqrt{\frac{4.3×1{0}^{-2}}{2}}$;所以同浓度的银离子需要的氯离子浓度小于铬酸根离子浓度,说明铬酸银溶解度大于氯化银;加入K2CrO4,做指示剂可以正确的测定氯化物的含量,故D选;
故答案为:D.
点评 本题考查较为综合,涉及反应速率、平衡常数、平衡移动以及电化学等知识,题目难度较大,注意把握影响平衡移动的因素以及平衡移动方向的判断.

 阅读快车系列答案
阅读快车系列答案
以下结论不正确的是( )
| A. | 甲、乙、丙三种单质全是非金属 | |
| B. | 上述转化关系所涉及的化合物中有一种是电解质 | |
| C. | 上图所示的五个转化关系中,有三个是化合反应 | |
| D. | 上图所示的五个转化关系中,均为放热反应 |
| A. | 1:9 | B. | 1:49 | C. | 1:99 | D. | 以上都不正确 |
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 利用腐蚀法制作印刷线路板:2Fe3++Cu═2Fe2++Cu2+ | |
| D. | 实验室用液溴和苯在催化剂作用下制溴苯: |
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
①A、D溶液呈碱性,B呈酸性,C呈中性,
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失,
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝,
回答下列问题
(1)A所含的阴离子的电子式是
 ,B所含的阳离子的结构示意图是
,B所含的阳离子的结构示意图是 ;
;(2)写出③中生成气体的离子方程式Ba2++CO32-+2NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+BaCO3↓;
(3)C的化学式是NaCl,
(4)简述D溶液呈碱性的理由NH4+的水解程度小于CO32-的水解程度.
| A. | 使用的NaOH固体在空气中敞口放置了一段时间 | |
| B. | 容量瓶用蒸馏水洗净后,未经干燥 | |
| C. | 在烧杯中溶解NaOH后,未经冷却即将溶液转入容量瓶 | |
| D. | 调节天平零点时未将游码回到最左边 |
| A. | 原电池是化学能转化成电能的装置 | |
| B. | 化学键断裂时吸收能量,形成时放出能量 | |
| C. | 化学反应中吸热反应时△H>0,放热反应时△H<0 | |
| D. | 标准状况下,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量为该物质的燃烧 |
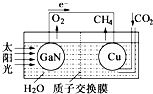 科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以
科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.以下说法错误的是( )
| A. | 铜电极表面的电极反应式 CO2+8e-+8H+=CH4+2H2O | |
| B. | 为提高该人工光合系统的工作效率,可向装置中加入少量硫酸 | |
| C. | 该装置仅将化学能转变为电能 | |
| D. | 装置中的H+由左向右移动 |
