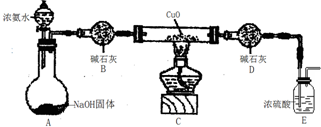
题目内容
15.A~J分别代表中学化学中常见的一种单质或化合物,其转化关系如图: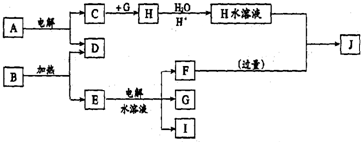
已知:A在工业上常用作耐火材料,D元素的原子最外层电子数是次外层的3倍,B加热制取D是实验室制取单质D的方法.C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态;请回答下列问题:
(1)写出实验室用B加热制取气体D的化学方程式:2KCl03$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑.
(2)用离子方程式表示过量F与H溶液反应Al3++4OH-=AlO2-+2H2O.
(3)写出C与一种常见金属的+3价氧化物反应的化学方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
分析 C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,D元素的原子最外层电子数是次外层的3倍,最外层电子数不超过8个,但K层为最外层不超过2个,所以D元素最外层电子数是6,次外层为K层,所以D单质是O2;
A在工业上常用作耐火材料,电解A能得到氧气和C,C是短周期元素形成的单质,为Al;则A是Al2O3;
B加热制取D是实验室制取单质D的方法,则B是KClO3,E是KCl,电解KCl水溶液得到Cl2、H2和KOH,Al能和氯气反应生成氯化铝,
所以G是Cl2、I是H2、F是KOH,H是AlCl3,AlCl3和过量KOH反应生成KAlO2,所以J是KAlO2,结合题目分析解答.
解答 解:C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,D元素的原子最外层电子数是次外层的3倍,最外层电子数不超过8个,但K层为最外层不超过2个,所以D元素最外层电子数是6,次外层为K层,所以D单质是O2;A在工业上常用作耐火材料,电解A能得到氧气和C,C是短周期元素形成的单质,为Al;则A是Al2O3;
B加热制取D是实验室制取单质D的方法,则B是KClO3,E是KCl,电解KCl水溶液得到Cl2、H2和KOH,Al能和氯气反应生成氯化铝,
所以G是Cl2、I是H2、F是KOH,H是AlCl3,AlCl3和过量KOH反应生成KAlO2,所以J是KAlO2,
(1)实验室用加热氯酸钾的方法制取氧气,反应方程式为2KCl03$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑,故答案为:2KCl03$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑;
(2)AlCl3和过量KOH反应生成KAlO2,离子方程式为Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O;
(3)C是Al,铝和氧化铁发生铝热反应生成Fe,反应方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
点评 本题考查无机物推断,侧重考查学生分析推断能力,涉及物质推断、铝热反应、离子方程式的书写、气体制取等知识点,熟悉常见物质之间的转化及物质性质是解本题关键,题目难度不大.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案| A. | 氢氧化钠用于治疗胃溃疡病人的胃酸过多症 | |
| B. | 在AlCl3溶液中加入过量氨水最终无沉淀生成 | |
| C. | 工业上可利用钠和TiCl4溶液反应制取金属Ti | |
| D. | 锅炉中水垢可用盐酸或醋酸除去 |
| 阳离子 | Na+、Al3+、Ba2+、NH4+ |
| 阴离子 | Cl-、OH-、CO32-、SO42- |
①A、D溶液呈碱性,B呈酸性,C呈中性,
②A溶液与B溶液反应生成白色沉淀,再加过量A,沉淀量减少,但不会完全消失,
③A溶液与D溶液混合并加热有气体生成,该气体能使湿润的红色石蕊试液变蓝,
回答下列问题
(1)A所含的阴离子的电子式是
 ,B所含的阳离子的结构示意图是
,B所含的阳离子的结构示意图是 ;
;(2)写出③中生成气体的离子方程式Ba2++CO32-+2NH4++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+BaCO3↓;
(3)C的化学式是NaCl,
(4)简述D溶液呈碱性的理由NH4+的水解程度小于CO32-的水解程度.
| A. | 金刚石的网状结构中,以共价键形成的最小碳环上有6个碳原子 | |
| B. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| C. | 氯化钠晶体中,每个Na+周围距离最近且相等的Na+共有6个 | |
| D. | 石墨晶体中,每一层内碳原子数与碳碳键数之比为2:3 |
| 物质 | 粒子数目 | 质量(m)(g) | 物质的量(n)(mol) | 摩尔质量(M)(g/mol) |
| 氦气(He) | 0.2 | |||
| S | 1.204×1023 | |||
| CO2 | 22 | |||
| C12H12O11 | 0.25 |
| A. | 3.0g C2H6的中含有公用电子对的数目为0.7×6.02×1023 | |
| B. | 25℃时,pH=1的醋酸中H+含有的数目为0.1×6.02×1023 | |
| C. | 已知2CO(g)+O2(g)?2CO2(g)△H=+-a kJ•mol-1,将2 NA 个CO与 NA 个O2混合,充分反应放出a kJ的热量 | |
| D. | 50mL 18.4mol•L-1 浓硫酸与足量铜微热反应生成 SO2分子数目为0.46NA |
| A. | 凡是含有离子键的化合物一定是离子化合物 | |
| B. | 含有共价键的化合物都是共价化合物 | |
| C. | 凡是能电离出离子的化合物都是离子化合物 | |
| D. | 非金属原子间以共价键结合的物质都是共价化合物 |

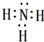 .
.